
【题目】硫的多种化合物在工业中有重要的应用.
(1)连二亚硫酸钠(Na2S2O4)又称保险粉,是最适合木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性.
①Na2S2O4中S元素的化合价为 .
②Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为l:2时,产物为(填化学式).
③将甲酸和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2 . 该反应的化学方程式为 .
(2)铬会造成环境污染.某酸性废水中含有Cr2O72﹣ , 处理时可用焦亚硫酸钠(Na2S2O3)将Cr2O转化为毒性较低的Cr3+ , 再调节pH至8,使铬元索沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg/L,达到排放标准.
①Na2S2O3参加反应的离子方程式为 .
②处理后的废水中Cr3+的物质的量浓度为mol/L.
【答案】
(1)+3;NaHSO3;HCOOH+2SO2+2NaOH=Na2S2O4+CO2+H2O
(2)3S2O52﹣+2Cr2O72﹣+10H+=6SO42﹣+4Cr3++5H2O;1×10﹣5
【解析】解:(1)①因为Na为+1价,O为﹣2价,根据化合价代数和为0,则S为+3价,故答案为:+3;②Na2S2O4暴露于空气中易被氧气氧化,则氧化剂为氧气,还原剂为Na2S2O4 , 又氧化剂和还原剂的物质的量之比为l:2,设Na2S2O4被氧化后硫的化合价为+x价,则根据得失电子守恒,1×4=2×2×(x﹣3),解得x=4,又有水蒸气参与反应,所以产物为NaHSO3;故答案为:NaHSO3;③根据题意,甲酸和NaOH溶液混合,再通入SO2气体,甲酸被氧化为CO2 , SO2气体被还原成Na2S2O4 , 则方程式为HCOOH+2SO2+2NaOH=Na2S2O4+CO2+H2O;故答案为:HCOOH+2SO2+2NaOH=Na2S2O4+CO2+H2O;(2)①焦亚硫酸钠(Na2S2O5)将Cr2O72﹣转化为毒性较低的Cr3+ , 同时焦亚硫酸钠被氧化为硫酸钠,其反应的离子方程式为:3S2O52﹣+2Cr2O72﹣+10H+=6SO42﹣+4Cr3++5H2O;故答案为:3S2O52﹣+2Cr2O72﹣+10H+=6SO42﹣+4Cr3++5H2O;②分离出污泥后测得废水中Cr3+浓度为0.52mg/L,c(Cr3+)= ![]() =1×10﹣5mol/L;
=1×10﹣5mol/L;
故答案为:1×10﹣5 .
(1)①根据化合价代数和为0分析;②Na2S2O4暴露于空气中易被氧气氧化,则氧化剂为氧气,还原剂为Na2S2O4 , 根据得失子守恒计算反应后产物;③根据题意,甲酸和NaOH溶液混合,再通入SO2气体,甲酸被氧化为CO2 , SO2气体被还原成Na2S2O4 , 据此书写方程式(2)①焦亚硫酸钠(Na2S2O5)将Cr2O72﹣转化为毒性较低的Cr3+ , 同时焦亚硫酸钠被氧化为硫酸钠,根据电子守恒和原子守恒书写方程式;
②根据分离出污泥后测得废水中Cr3+浓度为0.52mg/L计算Cr3+的物质的量浓度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】关于丙烯醛(CH2=CH﹣CHO)的下列叙述中,不正确的是( )
A.在丙烯醛分子中,含有两种官能团
B.丙烯醛能发生加聚反应,生成高聚物 ![]()
C.等物质的量的丙烯醛和丙醛完全燃烧,消耗等物质的量的O2
D.丙烯醛能使溴水褪色,能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关微量元素的下列说法中正确的是( )
A.微量元素虽然含量占人体的0.01%以下,但对于维持生命活动,促进健康和发育是极其重要的
B.微量元素对于维持生命活动,促进健康和发育没有重要作用
C.青少年或成人缺铁可引起甲状腺肿大
D.摄入的铁越多越有利于身体健康
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达不正确的是( )
A.分散质粒子直径与分散系种类: ![]()
B.NaOH溶液与CO2反应后溶液中的钠盐: 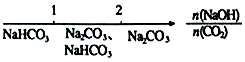
C.AlCl3溶液中滴加NaOH溶液后铝的存在形式: ![]()
D.Na与O2反应的产物: 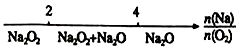
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的反应产物质量最大
D.两块钠的反应产物质量一样大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空
(1)通常用来衡量一个国家的石油化学工业发展水平的标志是年产量.
A.乙烯
B.乙炔
C.乙醇
D.乙烷
(2)写出下列反应的化学方程式,注明反应类型:
①实验室制取乙酸乙酯:
②由苯乙烯制取聚苯乙烯:;反应类型 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如图所示. 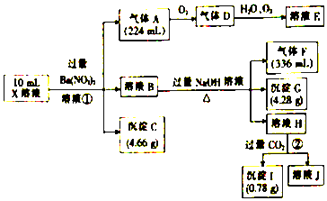
(1)通过上述实验过程,一定不存在的离子是 .
(2)反应①中生成A的离子方程式为 .
(3)若测得X溶液中c(H+)=5mol/L,则X溶液中(填“含”或“不含”)Fe3+ , c(Fe3+)=mol/L(若填不含,则不需计算),X溶液中c(Cl﹣)=mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把200mL NH4HCO3和Na2CO3的混合溶液分成二等份,取一份加入含a mol氢氧化钠的溶液加热,恰好使NH4+完全转化为NH3逸出,另取一份加入含b molHCl的盐酸恰好反应完全生成CO2 , 则该混合溶液中c(Na+)为( )
A.( ![]() ﹣
﹣ ![]() )mol/L
)mol/L
B.(2b﹣a) mol/L
C.(5b﹣ ![]() ) mol/L
) mol/L
D.(10b﹣5a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
A.该硫酸试剂的物质的量浓度为18.4
B.该硫酸与等体积的水混合所得溶液的质量分数小于49%
C.配制50.0mL4.6molL﹣1的稀硫酸需取该硫酸12.5mL
D.2.4gMg与足量的该硫酸反应得到H2 的体积为2.24L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com