
 一定温度下,在2L的密闭容器中,A、B、D三种气体的物质的量随时间变化的曲线如图所示.下列表述正确的是( )
一定温度下,在2L的密闭容器中,A、B、D三种气体的物质的量随时间变化的曲线如图所示.下列表述正确的是( )| A. | 反应的化学方程式为A(g)+B(g)?D(g) | |
| B. | 反应开始到10s,用B表示的反应速率为0.079mol/(L•s) | |
| C. | 在10s时,D的体积分数为71.8% | |
| D. | 反应开始到10s时,A的转化率为79% |
分析 A.根据物质的量的变化,判断出反应物、生成物及是否是可逆反应,利用物质的量之比化学计量数之比书写方程式;
B.反应开始到10s,B的物质的量变化为1.00mol-0.21mol=0.79mol,然后根据v=$\frac{\frac{△n}{V}}{△t}$计算出用B表示的反应速率;
C.10s时D的物质的量为1.58mol,相同条件下气体的体积分数=物质的量分数,据此计算出D的体积分数;
D.根据图象计算出10s时A的物质的量变化,然后计算出其转化率.
解答 解:A.由图象可以看出,由图表可知,随反应进行A、B的物质的量减小,D的物质的量增大,所以A、B是反应物,D是生产物,l0s后A、B、D的物质的量为定值,不为0,反应是可逆反应,且△n(A):△n(B):△n(D)=(1.20-0.41)mol:(1.00-0.21)mol:1.58mol=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,故反应化学方程式为A(g)+B(g)?2D(g),故A错误;
B.反应开始到10s,B的物质的量变化为1.00mol-0.21mol=0.79mol,则用B表示的反应速率为:$\frac{\frac{0.79mol}{2L}}{10s}$=0.0385mol/(L•s),故B错误;
C.10s时D的物质的量分数为:$\frac{1.58mol}{1.58mol+0.41mol+0.21mol}$×100%≈71.8%,相同条件下气体的体积分数等于其物质的量分数,所以D的体积分数为71.8%,故C正确;
D.从而开始到10s时,A的物质的量变化为:1.20mol-0.41mol=0.79mol,则A的转化率为:$\frac{0.79mol}{1.20mol}$×100%≈65.8%,故D错误;
故选C.
点评 本题考查物质的量随时间变化的曲线,题目难度中等,明确化学平衡及其影响为解答关键,分析图象注意一看点:即起点、拐点、交点、终点;二看线:即看曲线的变化趋势和走向;三看面:即看清纵坐标、横坐标表示的物理量等,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
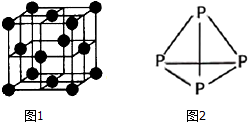 氨是重要的化工原料,用途广泛.
氨是重要的化工原料,用途广泛.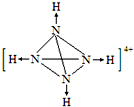 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非金属元素组成的化合物中一定不含离子键 | |
| B. | 离子化合物一定含有金属元素 | |
| C. | 分子中一定含有共价键 | |
| D. | 某种离子化合物可以同时含有离子键、极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炒菜时放入食盐并不破坏NaCl中的离子键 | |
| B. | HCl的电子式是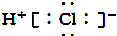 | |
| C. | HCl是共价化合物,但溶于水时电离出H+和Cl- | |
| D. | NaCl熔化时破坏共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 晶体名称 | 碘化钾 | 干冰 | 硫 | 碘 |
| 晶体中的微粒名称 | 阴、阳离子 | 分子 | 原子 | 分子 |
| 晶体内存在的结合力 | 离子键 | 范德华力 | 共价键 | 范德华力 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
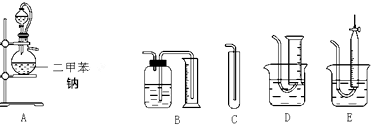
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com