

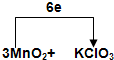
 ,
, ;
;| 2 |
| 5 |


科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、Ca2+、HCO3-、NO3- |
| B、Al3+、NH4+、Br-、Cl- |
| C、K+、MnO4-、S2-、SO42- |
| D、Na+、K+、SiO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、加入氨水至pH=7,c(NH4+)>c(C1-) |
| C、滴加浓盐酸可能有,c(NH4+)=c(H+) |
| D、加入少量CH3COONa固体,c(NH4+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡 常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g) CO2(g)+H2(g) | K3 | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:48 22 |
50 22 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高氯精由4种元素组成 |
| B、高氯精中C、O、N、Cl的原子个数比为1:l:1:1 |
| C、高氯精中C、N两种元素的质量比为12:14 |
| D、高氯精中氯元素的质量分数为25% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com