
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A |  | 1,5-二甲基-3-乙基苯 |
| B |  | 异戊二烯 |
| C |  | 2,5-二甲基-5-庚醇 |
| D | CH3 CH2CH2(C2H5)CHCH(CH3)2 | 2-甲基-3-正丙基戊烷 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2→NO2→HNO3 | B. | Fe→FeCl3→FeCl2 | ||
| C. | S→SO3→Na2SO4 | D. | Al2O3→Al(OH)3→NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇代替汽油作燃料,污染小,更环保 | |
| B. | 1mol 乙醇燃烧生成3mol水 | |
| C. | 1mol 乙醇与足量Na反应生成0.5 mol H2 | |
| D. | 乙醇可以制饮料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,则Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | Fe能与CuSO4溶液反应,可知Al与CuSO4溶液也能反应 | |
| C. | CaS03与稀盐酸反应生成SO2,可知CaSO3与稀硝酸反应也生成SO2 | |
| D. | 已知H2O2能氧化I一,可知H2O2也能氧化Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
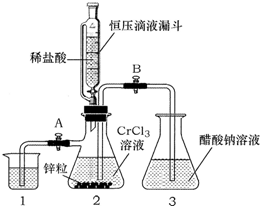 酣酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]2•2H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:
酣酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]2•2H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
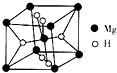 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com