
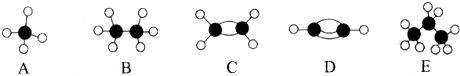
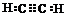 ,A的二氯取代物有1种.
,A的二氯取代物有1种.分析 根据球棍模型可知,A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷.
(1)D为乙炔,甲烷是正四面体;
(2)乙烯是植物生长调节剂;(3)甲烷与氯气发生取代反应生成一氯甲烷和氯化氢;
(4)乙烯中含有碳碳双键,一定条件下,乙烯和水发生加成反应生成乙醇.
解答 解:(1)D的化学式为C2H2,电子式: ,甲烷是正四面体,二氯取代物1种,故答案为:
,甲烷是正四面体,二氯取代物1种,故答案为: ;1;
;1;
(2)乙烯有催熟作用,是植物生长调节剂,结构简式:CH2=CH2,故答案为:CH2=CH2;
(3)乙烯中含有碳碳双键,在一定条件下,乙烯和水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.
点评 本题考查了有机物结构与性质、球棍模型的表示方法,题目难度中等,注意掌握常见有机物结构与性质,明确球棍模型表示的意义是解答本题关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 PbO2+Pb+2H2SO4,则该铅蓄电池在充电时阳极的电极反应式:PbSO4-2e-+2H2O═PbO2+SO42-+4H+.
PbO2+Pb+2H2SO4,则该铅蓄电池在充电时阳极的电极反应式:PbSO4-2e-+2H2O═PbO2+SO42-+4H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钠和金刚石 | B. | 晶体硅和水晶(SiO2) | ||
| C. | 水晶(SiO2)和干冰 | D. | NaCl和 I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置图如图所示.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:
工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com