
| A. | 提高溶液的温度 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2mol•L-1盐酸 | D. | 将溶液稀释到原体积的10倍 |
分析 A、提高温度促进醋酸的电离;
B、加入适量的醋酸钠固体,能抑制醋酸的电离;
C、加入等体积的0.2 mol•L-1盐酸,氢离子浓度增大;
D、加水稀释能促进水的电离,将溶液稀释到原体积的10倍,氢离子浓度大于原来的$\frac{1}{10}$.
解答 解:A、提高温度促进醋酸的电离,使溶液中氢离子浓度增大,溶液的pH值减小,故A错误;
B、加入适量的醋酸钠固体,醋酸钠中含有醋酸根离子能抑制醋酸的电离,使溶液中氢离子浓度减小,所以能使溶液pH=(a+1),故B正确;
C、加入等体积的0.2 mol•L-1盐酸,氢离子浓度增大,溶液的pH值减小,故C错误;
D、醋酸是弱电解质,加水稀释能促进水的电离,将溶液稀释到原体积的10倍,氢离子浓度大于原来的$\frac{1}{10}$,所以pH<(a+1),故D错误;
故选B.
点评 本题考查了弱电解质的电离,根据“加水稀释、提高温度都能促进醋酸的电离,加入含有相同离子的盐能抑制醋酸的电离”来分析解答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | H2在Cl2中燃烧、H2与Cl2的混合气体光照发生爆炸,都放出热量 | |
| B. | H2在O2中燃烧生成H2O放出能量,H2O分解为H2和O2吸收能量 | |
| C. | 氙和氟按一定比例混合,在一定条件下可直接发生反应:Xe+2F2═XeF4,该反应过程中Xe和F2都有化学键断裂 | |
| D. | 在CaO+H2O═Ca(OH)2的过程中CaO和H2O的总能量高于Ca(OH)2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y>Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | Z的氢化物水溶液和Y最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2Se的热稳定性比 H2S的稳定性强 | B. | SeO3的水化物是一种含氧酸 | ||
| C. | 硒元素有+6、+4、-2等常见化合价 | D. | Se的单质在常温下呈固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,强酸溶液的pH=a将溶液的体积稀释到原来10n倍,则pH=a+n | |
| B. | 已知 BaSO4的Ksp=c(Ba2+)•c(SO${\;}_{4}^{2-}$),所以在 BaSO4,溶液中有 c(Ba2+)=c(SO${\;}_{4}^{2-}$)=$\sqrt{{K}_{sp}}$ | |
| C. | 向硝酸押溶液中滴加稀盐酸得到的pH=4的混合溶液:c(k+)<c(NO${\;}_{3}^{-}$) | |
| D. | 将0.1mol•L-1的MaHS和0.1molL-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(0H-)=2c(H+)+c(HS-)+3c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
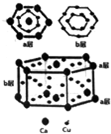 短周期元素A、B、C、D、E的原子序数依次增大,且原子最外层电子数之和为17.A是元素周期表中原子半径最小的元素,B原子的最外层电子数是其次最外层电子数的2倍,A与E同主族,D原子核外有2个未成对电子.
短周期元素A、B、C、D、E的原子序数依次增大,且原子最外层电子数之和为17.A是元素周期表中原子半径最小的元素,B原子的最外层电子数是其次最外层电子数的2倍,A与E同主族,D原子核外有2个未成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K越大,达到平衡时,反应进行的程度越大 | |
| B. | K随反应物浓度的改变而改变 | |
| C. | K越小,达到平衡时,反应物的转化率越大 | |
| D. | K随温度和压强的改变而改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com