
具有相同电子层结构的三种微粒An+、Bn-、C,下列分析正确的是( )
A.原子序数关系:C>B>A
B.微粒半径关系:Bn->An+
C.C微粒是稀有气体元素的原子
D.原子半径关系是A<B<C
 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| D | E | ||||||||||||||||
| G | Q | M | R | ||||||||||||||
| T | |||||||||||||||||
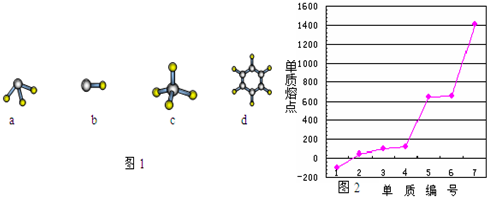
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com