
在298K、100kPa时,已知:2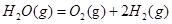 ⊿
⊿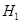
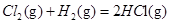 ⊿
⊿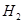
 ⊿
⊿
则⊿ 与⊿
与⊿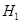 和⊿
和⊿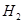 间的关系正确的是 ( )
间的关系正确的是 ( )
A
.⊿ =⊿
=⊿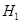 +2⊿
+2⊿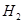 B. ⊿
B. ⊿ =⊿
=⊿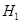 +⊿
+⊿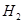
C.
⊿ =⊿
=⊿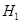 -2⊿
-2⊿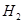 D. ⊿
D. ⊿ =⊿
=⊿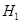 - ⊿
- ⊿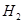
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)?N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)?N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com