
【题目】一定条件下,某容积为1L的密闭容器中发生如下反应:C(s)+H2O(g)CO(g)+H2(g)
(1)维持温度不变,向该容器中充入2mol C(s)和2molH2O(g),达到平衡后混合气体的平均分子量为M,则M的范围为
(2)在(1)中若起始时充入的是2.5molCO(g)和4mol H2(g),达到平衡后混合气体的平均相对分子质量为 .
【答案】
(1)15<M<18
(2)12
【解析】解:(1)反应前平均相对分子质量即为水蒸气的相对分子质量为18,假设C和水完全转化为CO和氢气,则生成2molCO和 2mol氢气,M= ![]() =
= ![]() =15g/mol,所以平均相对分子质量为15,故答案为:15<M<18;(2)
=15g/mol,所以平均相对分子质量为15,故答案为:15<M<18;(2) ![]() =
= ![]() =
= ![]() =12,故答案为:12. (1)利用极端假设法解答,反应前平均相对分子质量即为水蒸气的相对分子质量,假设C和水完全转化为CO和氢气,计算平均相对分子质量,据此解答;(2)2.5mol CO(g)和4mol H2 (g)的平均相对分子质量为12,假设生成xmolC,则气体质量减少2.5mol×28g/mol+4mol×2g/mol﹣12xg=78g﹣12xg,气体物质的量减少,2.5mol+4mol﹣xmol,据此计算平均相对分子质量.
=12,故答案为:12. (1)利用极端假设法解答,反应前平均相对分子质量即为水蒸气的相对分子质量,假设C和水完全转化为CO和氢气,计算平均相对分子质量,据此解答;(2)2.5mol CO(g)和4mol H2 (g)的平均相对分子质量为12,假设生成xmolC,则气体质量减少2.5mol×28g/mol+4mol×2g/mol﹣12xg=78g﹣12xg,气体物质的量减少,2.5mol+4mol﹣xmol,据此计算平均相对分子质量.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
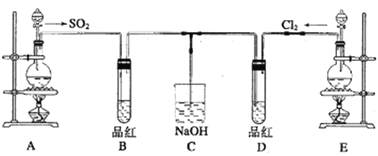
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗液体顺利滴下___________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为____________________,若实验室用酸性KMnO4和浓盐酸反应制Cl2,反应的离子方程式为________________________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:_______________________,D:_________________________。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为_____________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是( ) 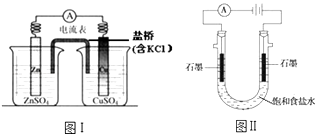
A.图Ⅰ,电流形成的完整过程是:负极Zn﹣2e﹣═Zn2+ , 电子经导线流向正极,正极Cu2++2e﹣═Cu
B.图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4 , 用石墨替换Cu棒
C.图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e﹣═H2↑
D.图Ⅱ,通电后,由于OH﹣向阳极迁移,导致阳极附近pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的流程图如下: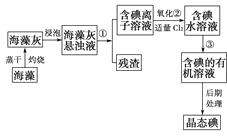
(1)指出提取碘的过程中有关的实验操作名称:
① , ③。
写出过程②中有关反应的离子方程式:。
(2)提取碘的过程中,可供选择的有机溶剂是( )(填序号)。
A.甲苯、酒精
B.四氯化碳、苯
C.汽油、乙酸
D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是。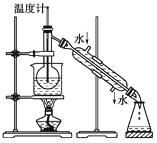
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
①;
②;
③。
(5)进行上述蒸馏操作时,使用水浴的原因是 , 最后晶体碘在里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水中含有CN-和Cr2O72-等离子,需经污水处理达标后小能排放,污水处理拟采用下列流程进行处理:
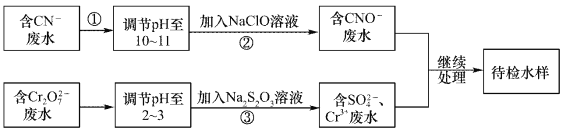
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为____________。
(2)步骤③的反应的离了方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),每消耗0.4mol Cr2O72-时,反应中S2O32-失去_________mol电子。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是___________________。
【答案】 CN-+ClO- = CNO-+Cl- 2.4 调节废水pH,使其转化为Cr(OH)3沉淀除去
【解析】(1)步骤②中,CN-被ClO-氧化为CNO-,因为是在碱性环境中,所以ClO-只能被还原为Cl-,因此反应的离子方程式为CN-+ClO- = CNO-+Cl-;(2)根据方程式可知,在反应中Cr元素的化合价从+6价降低到+3价,得到3个电子,所以0.4 mol Cr2O72-转化为Cr3+时转移电子的物质的量=0.4mol×(6-3)×2=2.4mol;(3)熟石灰是强碱,溶于水显碱性,所以含Cr3+废水中加入熟石灰进一步处理的目的是调节废水pH,使其转化为Cr(OH)3沉淀除去。
【题型】综合题
【结束】
30
【题目】用湿法制磷酸的副产品氟硅酸(H2SiF6)生成无水氟化氢的工艺如图所示:
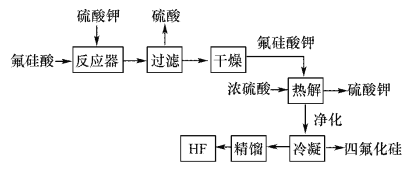
已知氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于酒精。
(1)写出反应器中的化学方程式:________________。
(2)在实验室过滤操作中所用的玻璃仪器有_____________,在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是:____________。
(3)该流程中哪些物质可以循环使用:_____________。(用化学式表达)
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6,试写出该反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.06mol FeCl2加入100mLK2Cr2O7溶液中,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-被还原为Cr3+。则K2Cr2O7溶液的物质的量浓度为( )
A. 0.4mol/L B. 0.2mol/L C. 0.1mol/L D. 0.08mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A.标准状况下,Cl2的摩尔质量为71g
B.氧化还原反应一定有氧元素参加
C.国际上规定,0.012kg 12C所含有的碳原子数约为1mol
D.Na2CO3属于钠盐,又属于碳酸盐是用交叉分类法分类的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液含有的氯离子物质的量浓度最大的是( )
A.2mL0.2mol/LNaCl溶液B.1mL0.2mol/LKCl溶液
C.1mL0.2mol/LCaCl2溶液D.1mL0.1mol/LAlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu=2Fe2++ Cu2+。下列有关说法错误的是
A.Cu是还原剂,被腐蚀B.FeCl3是氧化剂
C.该反应是置换反应D.该反应属于离子反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com