
【题目】一定量的铁与稀盐酸反应,生成了标准状况下4.48L氢气.
(1)计算发生反应的铁的物质的量为多少?(写出计算过程)
(2)若所用盐酸的浓度为0.5molL﹣1 , 则至少需要盐酸的体积为升?
(3)若上述稀盐酸是用密度为1.19g/cm3、质量分数为36.5%的浓盐酸稀释得到,则该浓盐酸的物质量浓度是molL﹣1 .
【答案】
(1)解:n(H2)= ![]() =0.2mol,根据转移电子守恒得n(Fe)=
=0.2mol,根据转移电子守恒得n(Fe)= ![]() =0.2mol,答:n(H2)=
=0.2mol,答:n(H2)= ![]() =0.2mol,根据转移电子守恒得n(Fe)=
=0.2mol,根据转移电子守恒得n(Fe)= ![]() =0.2mol
=0.2mol
(2)0.8
(3)11.9
【解析】解:(1)n(H2)= ![]() =0.2mol,根据转移电子守恒得n(Fe)=
=0.2mol,根据转移电子守恒得n(Fe)= ![]() =0.2mol,答:n(H2)=
=0.2mol,答:n(H2)= ![]() =0.2mol,根据转移电子守恒得n(Fe)=
=0.2mol,根据转移电子守恒得n(Fe)= ![]() =0.2mol;(2)根据H原子守恒得n(HCl)=2n(H2)=2×0.2mol=0.4mol,盐酸体积=
=0.2mol;(2)根据H原子守恒得n(HCl)=2n(H2)=2×0.2mol=0.4mol,盐酸体积= ![]() =0.8L,所以答案是:0.8;(3)浓盐酸物质的量浓度=
=0.8L,所以答案是:0.8;(3)浓盐酸物质的量浓度= ![]() =
= ![]() mol/L=11.9mol/L,
mol/L=11.9mol/L,
所以答案是:11.9.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74×10-3 | |
下列说法不正确的是( )
A. 该反应正反应为吸热反应
B. 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C. 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D. 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是
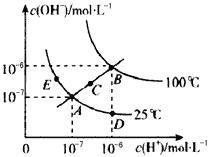
A. 图中五点Kw间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量酸的方法
C. 若从A点到C点,在温度不变时向水中加入适量NH4Cl固体
D. 若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g) 反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是 ( )
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.30 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中烃的分子式排布规律,判断空格中烃的同分异构体数目是
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略). 
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为: .
装置B中饱和食盐水的作用是;
(2)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为色,打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是 .
(3)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式: .
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列对0.3mol/L的K2SO4溶液的说法中,正确的是
A. 1L溶液中含0.3NA个钾离子 B. 2L溶液中含0.6NA个SO42-
C. 2L溶液中钾离子浓度是1.2mol/L D. 2L溶液中含0.6 NA个离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com