
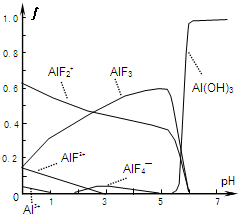
 Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是
Ⅰ.氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.(1)不能通过电解纯净的液态HF获得F2,其原因是| 温度/℃ | 1500 | 1800 | 2400 |
| 平衡常数K | 8.0×10-5 | 3.0×10-4 | 6.4×10-3 |
| 电离平衡常数 | |||
| 柠檬酸 | Ka1=7.1×10-4 | Ka2=1.68×10-5 | Ka3=4.1×10-7 |
| 氢氰酸 | Ka=4.93×10-10 | ||


科目:高中化学 来源: 题型:
| A、石油、煤、小苏打都是混合物 |
| B、烧碱、纯碱、碱石灰都是碱 |
| C、HNO3、NaOH、NaNO3都是电解质 |
| D、HCl、H2SO4、NaOH都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | Ⅰ | 0 | ||||||
| 1 | ① | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | |
| 2 | ② | ④ | ||||||
| 3 | ⑤ | ③ | ⑥ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.
A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.查看答案和解析>>
科目:高中化学 来源: 题型:
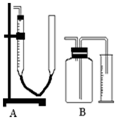 实验室常用如图所示的两套装置测量所制得气体的体积,下面有关这两套量气装置的使用说明有错误的是( )
实验室常用如图所示的两套装置测量所制得气体的体积,下面有关这两套量气装置的使用说明有错误的是( )| A、使用A装置量气前,其右管中应充满相应的液体 |
| B、量气前,B装置中广口瓶通常应盛满相应的液体 |
| C、A装置收集完气体后,在读数前应使盛液管内液面与集气管内液面相平 |
| D、A装置是直接测量气体体积,而B装置直接测量的是所排出液体的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com