
| A. | CO2分子比例模型: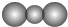 | |
| B. | 中子数为21的钾原子:4019K | |
| C. | NH4I的电子式: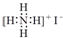 | |
| D. | HCO3-的电离方程式:HCO3-+H2O?H3O++CO32- |
分析 A.二氧化碳分子中,碳原子的相对体积大于氧原子;
B.元素符号的左上角为质量数、左下角为质子数;
C.碘离子为阴离子,电子式中需要标出最外层电子;
D.碳酸氢根离子电离出碳酸根离子和水合氢离子.
解答 解:A.二氧化碳分子中,碳原子的相对体积大于氧原子,其正确的比例模型为: ,故A错误;
,故A错误;
B.中子数为21的钾原子的质量数为40,该原子正确的表示方法为:1940K,故B错误;
C.该没有标出碘离子的最外层电子,NH4I正确的电子式为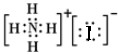 ,故C错误;
,故C错误;
D.HCO3-电离出碳酸根离子和水合氢离子,其电离方程式为:HCO3-+H2O?H3O++CO32-,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、比例模型、元素符号、电离方程式等知识,明确常见化学用语的书写原则为解答结构,试题有利于提高学生的分析能力及规范答题能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
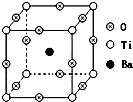 如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
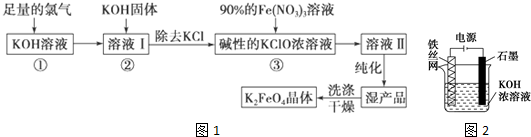
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
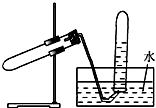 如图所示装置可用于( )
如图所示装置可用于( )| A. | 加热NaHCO3制CO2 | B. | 用Cu和浓HNO3反应制NO2 | ||
| C. | 用Zn与稀硫酸反应制H2 | D. | 用NaCl与浓H2SO4加热制HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na>Mg | B. | 热稳定性:HF>HCl | ||
| C. | 酸性:H2SO3>H2CO3 | D. | 氧化性:O2>S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
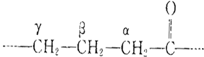

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
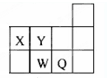
| A. | 元素X与元素Y可形成多种化合物 | |
| B. | 原子半径的大小顺序为:X>Y>W>Q | |
| C. | 还原性:W2-<Q- | |
| D. | 元素W的最高价氧化物对应水化物的酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
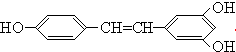 广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性,下列关于白藜芦醇的说法错误的是( )
广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性,下列关于白藜芦醇的说法错误的是( )| A. | 白藜芦醇属于三元醇,能与Na反应产生H2 | |
| B. | 能与NaOH反应,1mol该化合物最多能消耗NaOH 3mol | |
| C. | 能使FeCl3溶液显色 | |
| D. | 能与浓溴水反应,1mol该化合物最多能消耗溴6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com