
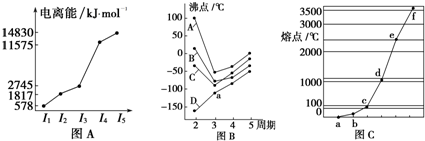
分析 (1)根据图A可知,M元素的第四电离能剧增,说明M原子易失去三个电子,最外层电子数为3;
(2)在ⅣA~ⅦA中的氢化物里,由于N、O、F电负性大,NH3、H2O、HF因在分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,a为第三周期ⅣA族元素氢化物;
(3)Na、Cu、Si、H、C、N等元素单质中,Na、Cu为金属晶体,均是热和电的良导体,Cu沸点高于NA,C、Si的单质为原子晶体,且C单质的熔沸点大于Si原子晶体的熔沸点,H、N对应的单质为分子晶体,其中氢气的熔点最低,由图熔点的高低顺序可知,a为H,b为N,c为Na,d为Cu,e为Si,f为C,a、b、f对应的元素以原子个数比1:1:1形成的分子为HCN,结构式为H-C≡N.
解答 解:(1)根据图A可知,M元素的第四电离能剧增,说明M原子易失去三个电子,最外层电子数为3,故为第ⅢA族元素,故答案为:ⅢA族;
(2)在ⅣA~ⅦA中的氢化物里,由于N、O、F电负性大,NH3、H2O、HF因在分子间存在氢键,强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,a为第三周期ⅣA族元素氢化物H2S,
故答案为:H2S;NH3、H2O、HF因在分子间存在氢键,强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点;
(3)Na、Cu、Si、H、C、N等元素单质中,Na、Cu为金属晶体,均是热和电的良导体,Cu沸点高于NA,C、Si的单质为原子晶体,且C单质的熔沸点大于Si原子晶体的熔沸点,H、N对应的单质为分子晶体,其中氢气的熔点最低,由图熔点的高低顺序可知,a为H,b为N,c为Na,d为Cu,e为Si,f为C,a、b、f对应的元素以原子个数比1:1:1形成的分子为HCN,结构式为H-C≡N,分子中含2个σ键,2个π键,
故答案为:2;2.
点评 本题是对物质结构的考查,涉及电离能、氢键、熔沸点比较、化学键等,根据图示推出各对应元素是解答关键,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸常显黄色的原因是浓硝酸中溶有少量NO2 | |
| B. | 氯水和二氧化硫都能使品红溶液褪色 | |
| C. | 漂白粉长期暴露在空气中会变质 | |
| D. | 蔗糖中加入浓硫酸固体颜色变黑,说明浓硫酸具有吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镁中滴加盐酸:H++OH-═H2O | |
| B. | 在硫酸氢钾溶液中加入氢氧化钡溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向次氯酸钠溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com