
【题目】下列叙述正确的是
A. 等量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同
B. 等量的铜分别与足量浓、稀硝酸充分反应,生成气体的物质的量相同
C. 等量的铝分别与氢氧化钠溶液和盐酸充分反应,生成气体体积一定相同
D. 等量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同
【答案】D
【解析】
A. 根据化学反应Cl2+2NaOH=NaCl+NaClO+H2O、Cl2+Na2S=S↓+2NaCl来分析电子转移情况;B.铜与浓硝酸反应关系为:Cu-2e—-2NO2;铜与稀硝酸反应关系为3Cu-6e—-2NO;据以上关系解答;C. 铝与盐酸反应关系:2Al-6HCl-3H2;铝与氢氧化钠溶液反应关系:2Al-2NaOH-3H2;据以上关系分析;D. 根据化学反应2Fe+3Cl2![]() 2FeCl3、Fe+S
2FeCl3、Fe+S![]() FeS进行分析。
FeS进行分析。
A. 根据化学反应Cl2+2NaOH=NaCl+NaClO+H2O可知转移1mole-、Cl2+Na2S=S↓+2NaCl可知转移2mole-,氯气的物质的量相等,转移电子数之比为1:2,不相同, A错误;B.在铜与硝酸反应的过程中,铜失去电子的总数相等,浓硝酸中的N由+5价得一个电子生成NO2,而稀硝酸中的N由+5价得3个电子生成NO,所以生成气体的物质的量不相同,B错误;C.等量的铝与盐酸或NaOH溶液反应,消耗酸碱的物质的量不相等,所以若酸碱不足,则生成的气体体积有可能不相同,C错误;D.根据化学反应,2Fe+3Cl2![]() 2FeCl3、Fe+S
2FeCl3、Fe+S![]() FeS,铁的物质的量相等,生成物的物质的量相同,D正确; 正确选项D。
FeS,铁的物质的量相等,生成物的物质的量相同,D正确; 正确选项D。


科目:高中化学 来源: 题型:
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法错误的是

A. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
B. 充电时,Mo(钼)箔接电源的负极
C. 充电时,Na+通过交换膜从左室移向右室
D. 外电路中通过0.2mol电子的电量时,负极质量变化为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:
Na2SO3+S+5H2O![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6gNa2SO3于100mL烧杯中,加50mL去离子水搅拌溶解。
②另取4.0g硫粉于200mL烧杯中,加6mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉网小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中,_________________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为__________________________。
(4)滤液中除Na2S2O3 和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00g产品(硫代硫酸钠晶体的摩尔质量为248g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/LI2的标准溶液滴定,反应的离子方程式为:2S2O32-+I2=S4O62-+2I-,记录数据如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.30 | 21.32 |
2 | 0.36 | 22.56 |
3 | 0.10 | 21.08 |
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3 常用于脱氯剂,在溶液中易被Cl2 氧化为SO42-,该反应的离子方程式为 _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置进行实验:加热钠至熔化后,停止加热并通入氯气,钠剧烈燃烧并生成大量白烟。以下叙述错误的是
![]()
A. 钠着火燃烧产生苍白色火焰
B. 反应生成的大量白烟是氯化钠固体小颗粒
C. 棉球处发生的化学反应是: Cl2+2NaOH=NaCl+NaClO+H2O
D. 可在棉球右侧用湿润的淀粉碘化钾试纸判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、![]() 等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示,下列有关说法正确的是( )
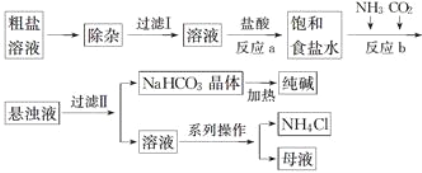
A. 在“侯氏制碱法”中涉及到了氧化还原反应
B. 饱和食盐水中先通入的气体为CO2
C. 流程图中的系列操作中一定需要玻璃棒
D. 工艺中只有碳酸氢钠加热分解产生的CO2可回收循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,但对维持生物体正常生命活动必不可少的元素有( )
A. Fe、Mn、Zn、Mg B. Zn、Cu、Mg、Ca
C. Zn、Cu、B、Mn D. Mg、Mn、Cu、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料生产铝和氮化铝的一种工艺流程如下[已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀]。

(1)操作I、Ⅱ的名称为____________。
(2)用氧化物的形式表示铝硅酸钠的化学式_____________。
(3)杂质Fe2O3最后存在于___________中。
(4)工业制备Al的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行 “铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
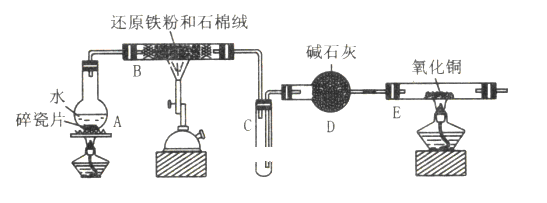
(1)装置B中发生反应的化学方程式是_________________________________________
(2)装置E中的现象是:_____________________________________________________
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中 Fe3+的操作方法:____________________________________________________________________
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
步骤I中通入Cl2的作用是____________________________
该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com