
| A.砷在通常状况下是固体 | B.可以有-3、+3、+5等多种化合价 |
| C.As2O5对应水化物酸性比H3PO4弱 | D.砷的还原性比磷弱 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.原子半径:Na<Cl | B.离子半径:F-<Mg2+ |
| C.热稳定性:HF>HCl | D.碱性:NaOH> Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.非金属 性:X<Y<Z 性:X<Y<Z | B.含氧酸的酸性:H3ZO4>H2YO4>HXO 4 4 |
| C.气态氢化物稳定性:按X、Y、Z顺序增加 | D.元素电负性:按X、Y、Z变小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
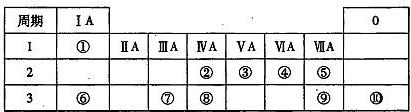
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.A–x+n+48 | B.A–x+n+24 | C.x-n–24 | D.X+n–24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com