
【题目】金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
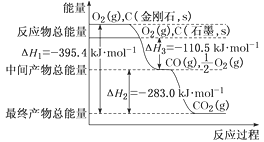
(1)在通常状况下,金刚石和石墨相比较,___(填“金刚石”或“石墨”)更稳定。
(2)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1。N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。NO分子中化学键的键能为___kJ·mol-1。
(3)综合上述有关信息,请写出用CO除去NO的热化学方程式:___。
【答案】石墨 631.5 2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.0kJ·mol-1
【解析】
(1)物质的能量越高,越不稳定;
(2)根据焓变ΔH=反应物的键能之和-生成物的键能之和,计算NO分子中化学键的键能;
(3)利用盖斯定律结合已知热化学方程式计算反应热,再写出热化学方程式。
(1)根据图象,金刚石能量高于石墨,能量越低,越稳定,所以石墨稳定,故答案为:石墨;
(2)根据N2、O2分子中化学键的键能分别是946kJmol-1、497kJmol-1以及反应N2(g)+O2(g)=2NO(g)△H=+180kJmol-1可设NO分子中化学键的键能为x,根据焓变ΔH=反应物的键能之和-生成物的键能之和,有:946kJmol-1+497kJmol-1-2x=180kJmol-1 ,解得:x=631.5kJmol-1,故答案为:631.5;
(3)根据图像,①C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJmol-1 ,②C(石墨,s)+![]() O2(g)═CO(g)△H=-110.5 kJmol-1,③N2(g)+O2(g)=2NO(g)△H=+180kJmol-1,根据盖斯定律,将①×2-②×2-③得:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=(-393.5 kJmol-1)×2-(-110.5 kJmol-1)×2-(+180kJmol-1)=-746.0kJmol-1,故答案为:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.0kJmol-1。
O2(g)═CO(g)△H=-110.5 kJmol-1,③N2(g)+O2(g)=2NO(g)△H=+180kJmol-1,根据盖斯定律,将①×2-②×2-③得:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=(-393.5 kJmol-1)×2-(-110.5 kJmol-1)×2-(+180kJmol-1)=-746.0kJmol-1,故答案为:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.0kJmol-1。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次递增的短周期主族元素。Y、W同主族,且W的核电荷数是Y的2倍,X、Y、W三种元素原子的最外层电子数之和为17,Y与Z可形成离子化合物Z2Y和Z2Y2。
(1)W在元素周期表中的位置为___。
(2)Z的最高价氧化物的水化物的电子式是___,其熔化时克服的作用力为___。
(3)Y、Z、W的原子半径从大到小的顺序是___(用元素符号表示)。
(4)X的简单气态氢化物和W最高价氧化物的水化物反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C12H14O2的有机物F广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。
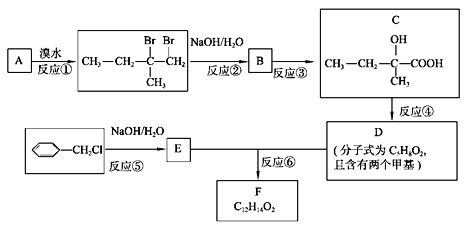
试回答下列问题:
(1) C物质中含有的官能团名称是__________,________;A物质的名称为_____________;
(2) 合成路线中反应③的反应类型为_________;
(3) 写出E的结构简式_________________,反应⑤的化学方程式为______________________;
(4) 按要求写出E的一种同分异构体的结构简式。要求:① 属于芳香族化合物。② 遇浓溴水能产生白色沉淀。___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法不正确的是 ( )
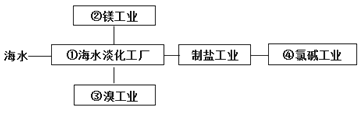
A.①中可采用蒸馏法
B.②中将MgCl2溶液蒸干即可得到无水MgCl2
C.③中提溴涉及到氧化还原反应
D.④的产品可生产盐酸、漂白液等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。

(1) 装置A中发生反应的化学方程式为___________。
(2) 装置D中试管口放置的棉花应浸一种溶液,这种溶液是______,其作用是___________。
(3) 装置B的作用是贮存多余的气体,当D处有明显的现象后,关闭旋塞K,移去酒精灯, 但由于余热的作用,A处仍有气体产生,此时B中现象是____。
Ⅱ.乙酸乙酯广泛用于药物、染料、香料等工业,甲、乙两同学分别设计如下装置来 制备乙酸乙酯,已知:乙酸乙酯的沸点为77.1℃,CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
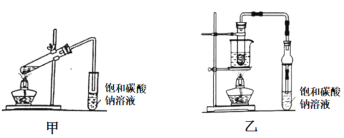
(1)甲装置中右边导管未插入溶液中的目的是 _________。
(2)实验结束后分离出乙酸乙酯的操作是______,必须用到的玻璃仪器有_______(填序号)。
A. 烧杯 B. 容量瓶 C. 分液漏斗 D. 蒸馏烧瓶
(3)乙装置优于甲装置的理由________ (写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或电离方程式正确的是( )
A. NaHSO3溶液呈酸性:NaHSO3===Na++H++SO32-
B. 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O===H2SiO3↓+CO32-
C. 将一小块钠投入稀醋酸中:2Na+2H+===2Na++H2↑
D. 在Na2S2O3溶液中滴加稀硝酸:2H++S2O32-===S↓+SO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
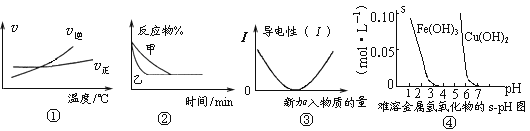
A. 根据图①可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
B. 图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写错误的是
A. HCO3-的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. Cu2+的水解方程式:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
C. NH4+的水解方程式:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com