
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 四种元素的单质中,Z单质的熔沸点最高 | |
| D. | X的单质能与H2反应,生成一种弱酸性的物质 |
分析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是次外层电子数的3倍,由于最外层电子数不能超过8,Y原子只能有2个电子层,次外层电子数为2,最外层电子数为6,则Y为O元素,由图中的位置可知,X为N元素,Z为S元素,W为Cl元素.
A.同周期元素的从左到右原子半径逐渐减小,一般电子层数越多原子半径越大;
B.同周期元素从左到右元素的非金属性逐渐增强,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强;
C.四种元素的单质中,常温下Z的单质是固体,其余均是气体;
D.氮气与氢气反应生成氨气.
解答 解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是次外层电子数的3倍,由于最外层电子数不能超过8,Y原子只能有2个电子层,次外层电子数为2,最外层电子数为6,则Y为O元素;由图中的位置可知,X为N元素,Z为S元素,W为Cl元素.
A.同周期元素的从左到右原子半径逐渐减小,一般电子层数越多原子半径越大,所以原子半径大小顺序为:Z>W>X>Y,故A错误;
B.同周期元素从左到右元素的非金属性逐渐增强,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,可知最高价氧化物对应水化物的酸性:W>Z,故B错误;
C.四种元素的单质中,常温下Z的单质是固体,其余均是气体,故Z单质硫的熔、沸点最高,故C正确;
D.氮气与氢气反应生成氨气,氨气属于碱性气体,故D错误.
故选:C.
点评 本题考查位置结构性质关系,推断元素是解答本题的关键,注意把握元素周期律的递变规律,熟练掌握元素化合物性质.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
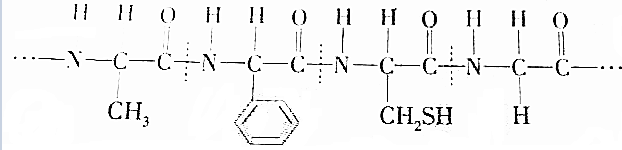
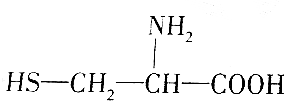 (半胱氨酸)
(半胱氨酸)| A. | ①②③ | B. | ②③④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 | |
| 主要化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A. | ③和⑥、④和⑦分别处于同一主族 | |
| B. | 元素④处于第3周期ⅤA族 | |
| C. | 元素①与元素⑥形成的化合物中不可能存在共价键 | |
| D. | 元素⑧对应的最高价氧化物及其水化物都具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡含离子键的化合物,一定含金属元素 | |
| B. | 在化合物MgCl2中,两个氯离子之间也存在离子键 | |
| C. | 离子化合物中不可能有共价键 | |
| D. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定是第2周期元素 | B. | 一定是同一主族元素 | ||
| C. | 可能是第2、3周期元素 | D. | 可以相互化合形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和H2在一定条件下反应生成NH3 | B. | NO与O2反应生成NO2 | ||
| C. | NH3催化氧化生成NO和H2O | D. | 由NH3制NH4HCO3和(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
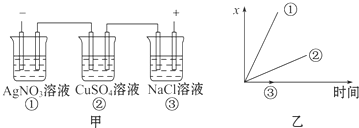
| A. | 各电解池析出气体体积总数的变化 | B. | 各电解池阳极质量的增加 | ||
| C. | 各电解池阴极质量的增加 | D. | 各电极上放电的离子总数的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com