
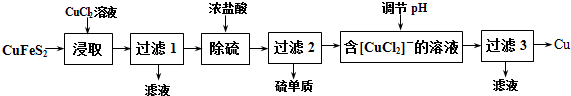
·ÖĪö CuFeS2¼ÓČėCuCl2½žČ”·¢ÉśCuFeS2+3CuCl2=4CuCl+FeCl2+2S£¬¹żĀĖŗóµĆµ½ĀĖŅŗŗ¬ÓŠFeCl2£¬¹ĢĢåŗ¬ÓŠCuCl”¢S£¬¼ÓČėŃĪĖį³żĮņ£¬¹żĀĖµĆµ½ĀĖŅŗŗ¬ÓŠ[CuCl2]-£¬µ÷½ŚČÜŅŗpH·¢ÉśĘē»Æ·“Ӧɜ³ÉCuŗĶCu2+£¬¹żĀĖæɵƵ½Cu£¬µĆµ½ĀĖŅŗŗ¬ÓŠCu2+£¬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£ŗCuFeS2¼ÓČėCuCl2½žČ”·¢ÉśCuFeS2+3CuCl2=4CuCl”ż+FeCl2+2S”ż£¬¹żĀĖŗóµĆµ½ĀĖŅŗŗ¬ÓŠFeCl2£¬¹ĢĢåŗ¬ÓŠCuCl”¢S£¬¼ÓČėŃĪĖį³żĮņ£¬¹żĀĖµĆµ½ĀĖŅŗŗ¬ÓŠ[CuCl2]-£¬µ÷½ŚČÜŅŗpH·¢ÉśĘē»Æ·“Ӧɜ³ÉCuŗĶCu2+£¬¹żĀĖæɵƵ½Cu£¬µĆµ½ĀĖŅŗŗ¬ÓŠCu2+£¬
£Ø1£©CuFeS2ŗĶ3FeCl3Ö®¼ä·¢ÉśµÄŹĒŃõ»Æ»¹Ō·“Ó¦£¬»Æѧ·½³ĢŹ½ĪŖ£ŗCuFeS2+3FeCl3=CuCl+4FeCl2+2S£¬
¹Ź“š°øĪŖ£ŗCuFeS2+3FeCl3=CuCl+4FeCl2+2S£»
£Ø2£©¹żĀĖ1ĖłµĆĀĖŅŗÖŠÖ»ŗ¬FeCl2£¬½«ĘäŌŚæÕĘųÖŠ¼ÓČČÕōøÉ”¢×ĘÉÕŗ󣬼ÓČė·¢ÉśÖŠ·¢ÉśĖ®½āÉĻ»š³µĒāŃõ»ÆŃĒĢś£¬ĒāŃõ»ÆŃĒĢś±»Ńõ»ÆÉś³ÉĒāŃõ»ÆĢś£¬ĒāŃõ»ÆĢś×ĘÉÕ·Ö½āÉś³ÉŃõ»ÆĢś£¬ĖłµĆ¹ĢĢåĪŖFe2O3£¬¹Ź“š°øĪŖ£ŗFe2O3£»
£Ø3£©¹żĀĖµĆµ½ĀĖŅŗŗ¬ÓŠ[CuCl2]-£¬µ÷½ŚČÜŅŗpH·¢ÉśĘē»Æ·“Ӧɜ³ÉCuŗĶCu2+£¬¹Ź“š°øĪŖ£ŗCu2+£»
£Ø4£©ĀĖ3ĖłµĆĀĖŅŗÖŠŗ¬ÓŠHClŗĶCuCl2£¬æÉŅŌŃ»·Ź¹ÓĆ£¬Éę¼°·“Ó¦ÓŠCuFeS2+3CuCl2=4CuCl+FeCl2+2S”¢2CuCl=Cu+CuCl2£¬×ŪŗĻĮ½øö»Æѧ·½³ĢŹ½æɵĆCuFeS2+CuCl2=2Cu+FeCl2+2S£¬ÓÉ·½³ĢŹ½æɵĆĆæÉś³É1molCu£¬ĄķĀŪÉĻŠč²¹³äCuCl2µÄĪļÖŹµÄĮæĪŖ0.5mol£¬
¹Ź“š°øĪŖ£ŗHClŗĶCuCl2£»0.5mol£»
£Ø5£©½«¾«Ń”ŗóµÄ»ĘĶæóÉ°ÓėæÕĘųŌŚøßĪĀĻĀģŃÉÕ£¬Ź¹Ęä×Ŗ±äĪŖĶ£¬·“Ӧɜ³É¶žŃõ»ÆĮņĘųĢ壬ĪŪČ¾æÕĘų£¬ĒŅÄÜŗÄøߣ¬
¹Ź“š°øĪŖ£ŗ»į²śÉśĪŪČ¾»·¾³µÄĘųĢåSO2£¬£ØÄÜŗÄøßµČ£©£®
µćĘĄ ±¾ĢāŅŌ¹¤ŅÕĮ÷³ĢĢāŠĪŹ½æ¼²éĶµÄ»ÆŗĻĪļµÄŠŌÖŹ”¢ĪļÖŹµÄ·ÖĄėĢį“攢»ÆѧÓĆÓļŹéŠ“µČ£¬ĪŖøßĘµæ¼µćŗĶ³£¼ūĢāŠĶ£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶŹµŃéÄÜĮ¦µÄ漲飬ĢāÄæÓŠĄūÓŚÅąŃųѧɜĮ¼ŗƵÄæĘѧĖŲŃų£¬ÄѶČÖŠµČ£¬Ē峞¹¤ŅÕĮ÷³ĢŌĄķŹĒ¹Ų¼ü£¬ŹĒ¶ŌÖŖŹ¶ĒØŅʵÄ×ŪŗĻŌĖÓĆ£®


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Īķö²µÄŠĪ³ÉÓė»ÆŹÆČ¼ĮĻµÄČ¼ÉÕÓŠ¹Ų | |
| B£® | ŗ£ÄĻ²»“ęŌŚĪķö²ĢģĘų£¬ĪŽŠč·ĄÖĪPM2.5µÄĪŪČ¾ | |
| C£® | ŌŚĪķö²ĢģĘųÖŠŠŠ³µ£¬“ņæŖ³µµĘæɹŪ²ģµ½¶”“ļ¶ūŠ§Ó¦ | |
| D£® | µ÷Õū¹¤ŅµÄÜŌ“½į¹¹£¬ĶĘ¹ćĒå½ąÄÜŌ“µÄŹ¹ÓĆ£¬ÄÜÓŠŠ§µŲ¼õÉŁPM2.5µÄĪŪČ¾ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
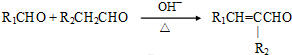 £Ø×¢£ŗR1æÉŅŌŹĒĢž»ł±¾£¬Ņ²æÉŅŌŹĒHŌ×Ó£©
£Ø×¢£ŗR1æÉŅŌŹĒĢž»ł±¾£¬Ņ²æÉŅŌŹĒHŌ×Ó£©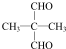 £®
£® ŗĶ
ŗĶ ·“Ó¦æÉÖʱø
·“Ó¦æÉÖʱø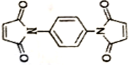 £®Č»ŗóŅŌ
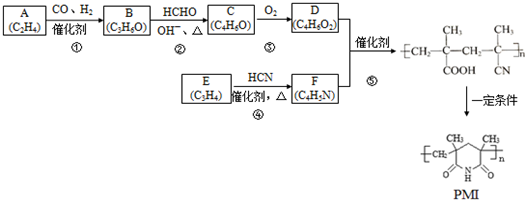
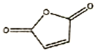
£®Č»ŗóŅŌ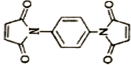 ĪŖµ„Ģå·¢Éś¾ŪŗĻ·“Ó¦æÉŗĻ³ÉĮķŅ»ÖÖ¾ŪŃĒõ£°·Ź÷Ö¬X£®øĆ¾ŪŗĻ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗn
ĪŖµ„Ģå·¢Éś¾ŪŗĻ·“Ó¦æÉŗĻ³ÉĮķŅ»ÖÖ¾ŪŃĒõ£°·Ź÷Ö¬X£®øĆ¾ŪŗĻ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗn $\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$
$\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$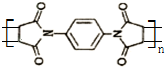 £ØXÖŠĪŽĢ¼Ģ¼Ė«¼ü£©
£ØXÖŠĪŽĢ¼Ģ¼Ė«¼ü£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CH3CH2CH2CH2CH2Cl | B£® | CH3CH2CHClCH2CH3 | ||
| C£® | 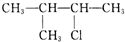 | D£® | 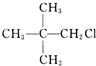 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
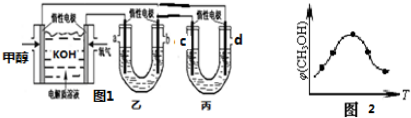
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ×å ÖÜĘŚ | IA | ¢ņA | ¢óA | ¢ōA | ¢õA | ¢öA | ¢÷A | 0 |
| 2 | ¢Ž | ¢ß | ||||||
| 3 | ¢Ł | ¢Ū | ¢Ż | ¢ą | ¢ā | |||
| 4 | ¢Ś | ¢Ü | ¢į |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2ÖÖ | B£® | 3ÖÖ | C£® | 4ÖÖ | D£® | 5ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
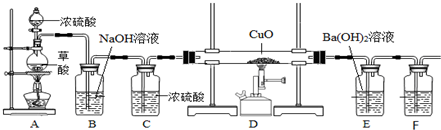
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
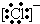 ¢Ū
¢Ū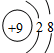 ¢ÜF- ĘäÖŠŗĖĶāµē×ÓŹżĻąĶ¬µÄŹĒ£Ø””””£©
¢ÜF- ĘäÖŠŗĖĶāµē×ÓŹżĻąĶ¬µÄŹĒ£Ø””””£©| A£® | ¢Ł¢Ū | B£® | ¢Ś¢Ū¢Ü | C£® | ¢Ś¢Ü | D£® | ¢Ł¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com