
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
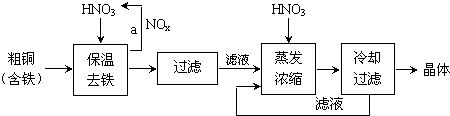
科目:高中化学 来源: 题型:选择题

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 装置丙:生成棕色的固体,证明Cl2有强氧化性 | |
| D. | 装置丁:湿润的有色布条褪色,证明Cl2有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1mol/L醋酸溶液加水稀释后,所有离子浓度均减小 | |
| B. | Na2CO3溶液中,一定有2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| D. | 1 mol•L-1HCN溶液与1mol•L-1NaOH溶液等体积混合后,测得所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 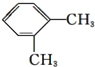 | B. |  | C. |  | D. | 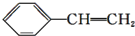 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液通入SO2:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 少量的Na2SO3溶液滴加到足量稀盐酸中:SO32-+2H+═H2O+SO2↑ | |
| D. | 硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H20═H2SiO3(胶体)+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
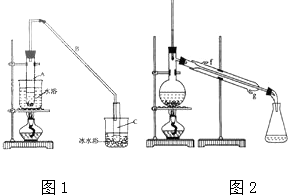 某化学小组以环己醇制备环己烯(如图1),
某化学小组以环己醇制备环己烯(如图1),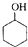 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$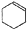 +H2O
+H2O| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com