
| A. | 乙烯、乙炔 | B. | 苯、四氯化碳 | C. | 乙烷、乙烯 | D. | 苯、酒精 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | HCO3-、Na+、H+ | B. | Cu2+、HCO3-、OH- | C. | OH-、A13+、SO42- | D. | Mg2+、Ca2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气的沸点低于氮气的沸点 | |
| B. | 稀有气体原子序数越大沸点越高 | |
| C. | 极性分子中一定不含非极性键 | |
| D. | 乙醇与水任意比互溶只是由于相似相溶原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
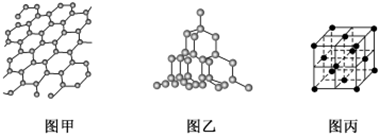
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl→CH3CH2Cl | B. | CH3CH3+Cl2→CH3CH2Cl+HCl | ||
| C. | C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O | D. |  +3NaOH$\stackrel{△}{→}$3C17H35COONa+ +3NaOH$\stackrel{△}{→}$3C17H35COONa+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40μg/m3 | B. | 80μg/m3 | C. | 100μg/m3 | D. | 160μg/m3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2015年3月5日,李克强总理在政府工作报告中说:“生态环保贵在行动,成在坚持,要求全年能耗强度下降3.1%以上”.从源头消除污染,这符合“绿色化学”的理念. | |
| B. | 农业废弃物、水生植物、油料植物、城市与工业有机废弃物、动物粪便等蕴藏着丰富的生物质能. | |
| C. | 尿液燃料电池的原理是在微生物的作用下将尿液中有机物的化学能转化为电能 | |
| D. | 石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
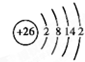 .
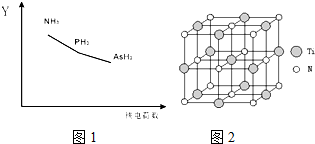
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com