
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
分析 根据分子式可知C11H16不饱和度为4,苯环的不饱和度为4,所以分子中除苯环外不含其它环状结构,侧链为烷基;分子中含有一个次甲基,两个甲基,所以满足条件的结构中只有一个侧链,据此写出可能的结构.
解答 解:C11H16不饱和度为$\frac{2×11+2-16}{2}$=4.苯环的不饱和度为4,所以分子中除苯环外不含其它环状结构,侧链为烷基;分子中含有一个次甲基,两个甲基,所以满足条件的结构中只有一个侧链,据化学式为C11H16的烃结构,分子中含两个甲基,两个亚甲基和一个次甲基,1个苯环的同分异构体有: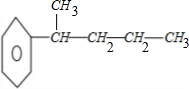 、
、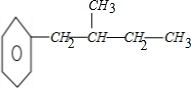 、
、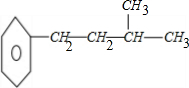 、
、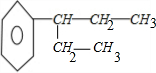 ,故选B.
,故选B.
点评 本题主要考查结构推断、同分异构体书写,难度较大,关键根据信息判断含有1个苯环及侧链结构特点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 具有相同结构式 | B. | 具有相同分子式 | ||
| C. | 具有不同相对分子质量 | D. | 具有不同原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在由水电离出的c(OH-)=1×10-13mol/L的溶液中:Na+、Al3+、Cl-、NO3- | |
| B. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 在澄清透明的溶液中:Cu2+、K+、SO42-、Cl- | |
| D. | 在能使甲基橙变黄色的溶液中:Na+、CO32-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ③⑥ | C. | ②④ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇(乙酸)--加水,振荡静置后分液 | |
| B. | SO2(CO2)--氢氧化钠溶液 | |
| C. | 乙烯(乙炔)--将气体通过盛KMnO4溶液的洗气瓶 | |
| D. | 苯(苯酚)--加足量NaOH溶液,振荡静置后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4•H2O•SO42-
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4•H2O•SO42-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com