
 氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是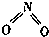 和
和 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
分析 (1)化学反应的反应热=反应物的总键能-生成物的总键能,注明物质的聚集状态与放热反应书写热化学方程式;
(2)①压强越高,反应速率越快;
②B、C两点的二氧化氮体积分数相同,为等效平衡;
③B的二氧化氮体积分数小于A点,该反应是吸热反应,温度升高,平衡正向移动,二氧化氮的体积分数增大,所以T2>T1;
④A、C点温度相同,C的压强增大,体积缩小,气体颜色加深;
(3)①从反应开始直至20 s时,N2O4(g)的物质的量增加0.05mol,则二氧化氮的物质的量减少0.1mol,浓度减少$\frac{0.1mol}{2L}$=0.05mol/L,再根据v=$\frac{△c}{△t}$计算v(NO2);
②若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,即为等效平衡状态,则将0.4mol的二氧化氮完全转化为四氧化二氮的物质的量是0.2mol.
解答 解:(1)根据化学反应的反应热=反应物的总键能-生成物的总键能,所以N2O4(g)?2NO2(g)的反应热△H=438.5 kJ•mol-1×4+167kJ•mol-1-466 kJ•mol-1×4=+57 Kj,•mol-1,所以N2O4转化为NO2的热化学方程式为:N2O4(g)?2NO2(g)△H=+57 kJ•mol-1,
故答案为:N2O4(g)?2NO2(g)△H=+57 kJ•mol-1;
(2)①C点压强大于A点,所以C点的反应速率快,即:v(A)<v(C),故答案为:<;
②B、C两点的二氧化氮体积分数相同,为等效平衡,则气体的平均相对分子质量相同,即:M(B=M(C),故答案为:=;
③B的二氧化氮体积分数小于A点,该反应是吸热反应,温度升高,平衡正向移动,二氧化氮的体积分数增大,所以T2>T1,A、B压强相同,则由状态B到状态A,可以用加热的方法,
故答案为:加热;
④A、C点温度相同,C的压强增大,体积缩小,气体颜色加深,尽管平衡逆向移动,但最终气体的颜色比原平衡时深,则A浅、C深,即:A点气体的颜色比C点浅,
故答案为:浅;A点到C点时压强增大,即体积减小,平衡逆移,NO2的体积分数减小,但平衡时C点c(NO2)比A点大;
(3)①在上述条件下,该反应为2NO2(g)?N2O4(g),从反应开始直至20 s时,N2O4(g)的物质的量增加0.05mol,则二氧化氮的物质的量减少0.1mol,浓度减少$\frac{0.1mol}{2L}$=0.05mol/L,二氧化氮的平均反应速率为:$\frac{0.05mol/L}{20s}$=0.0025mol•(L•s)-1,
故答案为:0.0025;
②若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,即为等效平衡状态,则将0.4mol的二氧化氮完全转化为四氧化二氮的物质的量是0.2mol,则四氧化二氮的起始浓度为:$\frac{0.20mol}{2L}$=0.10mol/L,
故答案为:0.10.
点评 本题考查化学平衡的计算,题目难度中等,涉及化学反应速率、平衡常数的计算、反应热的计算、平衡移动的判断、化学平衡图象、等效平衡的应用等知识,明确化学平衡及其影响为解答关键,试题培养了学生的分析能力及化学计算能力.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ④⑤⑥⑦ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 平衡时A气体在两容器中体积分数可能相等 | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A>B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | 若x=1,y=3,则达到平衡时反应物的转化率N>M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子半径:K+>Cl->Na+>F- | B. | 酸性:H2SO4>H3PO4>H2CO3>H2SiO3 | ||
| C. | 熔点:石英>食盐>钾>干冰 | D. | 还原性:NaCl>NaBr>NaI>Na2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S) | |
| B. | 浓度为0.1mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH=12的氨水与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的价电子排布中,①3s23p1 ②3s23p2 ③3s23p3④3s23p4,对应的第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④ | |
| D. | 某元素的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色透明的溶液中:Ca2+、NH4+、CO32-、HCOO- | |
| B. | 溶解有AlCl3的溶液中:Na+、K+、SO42-、S2- | |
| C. | 25℃时,水电离出的c(H+)=1×l0-l3mol/L的溶液中:K+、Ba2+、NO3-、I- | |
| D. | 离子浓度均为0.1mol/L的溶液中:Na+、Fe3+、CH3COO-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com