
Li﹣Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e﹣=Li2S+Fe.有关该电池的下列说法中,正确的是( )
|
| A. | Li﹣Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
|
| B. | 该电池的电池反应式为:2Li+FeS=Li2S+Fe |
|
| C. | 负极的电极反应式为Al﹣3e﹣=Al3+ |
|
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe﹣2e﹣=2Li++FeS |
| 电极反应和电池反应方程式;化学电源新型电池.. | |
| 分析: | Li和Al都属于金属,合金中Li较Al活泼,根据正极反应式知,原电池的电极材料Li﹣Al/FeS,判断出负极材料为Li,发生反应为:Li﹣e﹣=Li+,又知该电池中正极的电极反应式为:2Li++FeS+2e﹣=Li2S+Fe,所以电池反应为:2Li+FeS=Li2S+Fe,充电时为电解池原理,阴极发生还原反应,正确的反应式是2Li++2e﹣=2Li. |
| 解答: | 解:A、Li和Al都属于金属,所以Li﹣Al应该属于合金而不是化合物,因此化合价为0价,故A错误; B、根据正极反应2Li++FeS+2e﹣=Li2S+Fe与负极反应2Li﹣2e﹣=2Li+相加可得反应的电池反应式为:2Li+FeS=Li2S+Fe,故B正确; C、由正极反应式知负极应该是Li失去电子而不是Al,故C错误; D、充电时为电解池原理,阴极发生还原反应,正确的反应式是2Li++2e﹣=2Li,故D错误; 故选:B. |
| 点评: | 本题涵盖电解池和原电池的主体内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧废渣产生的SO2制备硫酸锰的生产流程如下:
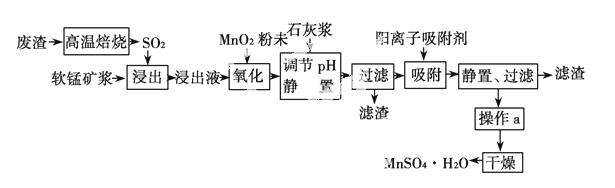
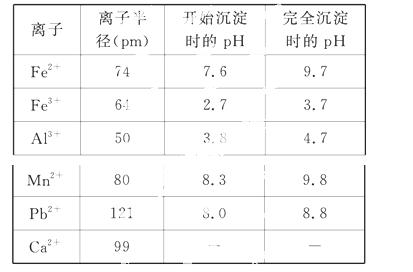
浸出液的pH<2,其中的金属离子主要是 Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。有关金属离子的半径以及形成氢氧化物沉淀时的pH如表所示,阳离子吸附剂吸附金属离子的效
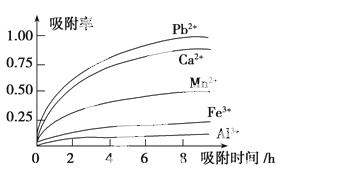
Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。有关金属离子的半径以及形成氢氧化物沉淀时的pH如表所示,阳离子吸附剂吸附金属离子的效 果如图所示。
果如图所示。
已知PbO2的氧化性大于MnO2的氧化性。请回答下列问题:
(1)废渣的主要成分是硫铁矿,1 mol F eS2高温焙烧转移________ mol电子。
eS2高温焙烧转移________ mol电子。
(2)在氧化后的浸出液中加入石灰浆,用于调节浸出液的pH,pH应调节至________。
(3)阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是________(填写序号)。
a.溶液的pH值 b.金属离子的电荷
c.金属离子的半径 d.吸附时间
(4)操作a包括________等过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:
| 物 质 | a | b | c | d |
| 反应前质量(g) | 6.4 | 3.2 | 4.0 | 0.5 |
| 反应后质量(g) | 待测 | 2.56 | 7.2 | 0.5 |
下列说法中错误的是:
A.a和b是反应物,d可能是催化剂。
B.反应后a物质的质量为4.64g
C.c物质中元素的种类,一定等于a、b二种物质中元素的种类
D.若物质a与物质b的相对分子质量之比为2:1,则a与b的化学计量数之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
16.8gNaHCO3和7.8gNa2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃,最后容器内物质是( )
|
| A. | Na2CO3,O2,H2O(g) | B. | Na2CO3,Na2O,O2 |
|
| C. | Na2CO3,CO2,O2,H2O(g) | D. | NaHCO3,Na2CO3,O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、U是分别位于短周期的元素,原子序数依次递增.X与W位于同一主族,Z元素的单质既能与盐酸反应也能与NaOH溶液反应,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13.Y元素的单质在X的某种氧化物中可燃.下列说法正确的是( )
|
| A. | W的最高价氧化物能与水反应生成相应的酸 |
|
| B. | Y、Z元素的单质作电极,在NaOH溶液下构成原电池,Z电极上产生大量气泡 |
|
| C. | 室温下,0.05 mol/L U的气态氢化物的水溶液的pH>1 |
|
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:
某盐X由非金属元素组成,不稳定加热时分解,生成等物质的量的气态氢化物A和B.A、C、E、G、I含有同种元素,C为黄色固体单质.B、D、F、H、J含有同种元素,B可与J反应生成盐.W是具有红色金属光泽的金属.上述物质转化关系如图,部分产物和条件已略去.请回答下列问题:

(1)X的化学式
(2)写出由E生成G的化学反应方程式
(3)写出反应B+Y→D+Z的化学方程式
(4)由E直接转换成I可以加入 (填写两种属于不同类别的物质).
(5)标况下,4.48LA与J的浓溶液反应转移1.6mole﹣,写出此反应的离子方程式 .
(6)将0.1mol/L 100mL I和0.4mol/L 100mL J溶液混合,加入1.92g W,加热,待充分反应后,所得溶液中W金属离子的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化:①导电、②爆炸、③缓慢氧化、④变色、⑤无水硫酸铜吸水、⑥工业制氧气、⑦白磷变成红磷、⑧久置浓HNO3变黄,一定属于化学变化的是( )
|
| A. | ①④ | B. | ⑥⑧ | C. | ②⑥⑦ | D. | ③⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列括号中的分离方法运用得当的是:( )
A.植物油和自来水(蒸馏) B.水溶液中的食盐和碘(分液)
C.CaCO3和CaCl2(溶解、过滤、蒸发) D.自来水中的杂质(萃取)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为( )
A.3,0mol B.1.5mol C.1.0mol D.0.75mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com