
【题目】下列各物质中,不能发生水解反应的是
A. 油脂B. 酶C. 纤维素D. 葡萄糖
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 糖类都是天然高分子化合物,组成与结构比较复杂
B. 可以用酸性高錳酸鉀溶液鉴别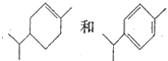
C. 体积分数为90%的乙醇溶液能使蛋白质变性,常用于医疗消毒
D. 甲苯的一溴代物和2一甲基丁烷的一溴代物都有4种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1 mol/L的HClO2和1 mol/L的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水稀释至体积为V,所得曲线如图所示。下列说法正确的是

A. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B. 在0≤pH≤5时,HMnO4溶液满足:pH=lg(V/V0)
C. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH:NaMnO4>NaClO2
D. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某化工厂提供的硒酸泥(主要含S、Se、Fe2O3及SiO2)中提取粗硒的工艺流程如下图所示:

备注:氧化浸出液中Se的含量为43.45g/L
根据以上信息回答下列问题:
(1)把煤油加热后再进行浸泡的目的是:__________________________。
(2)将含硫的滤液进行“冷却、结晶、过滤”操作可以除去煤油中的硫,由这一操作可推测硫的物理性质是:__________________________。
(3)“氧化浸硒”过程中:
①需要控制H2SO4的浓度至少为3mol/L,理由是:__________________________。
②硒转化为H2SeO3并生成一种黄绿色的气体,此过程的化学方程式为_______________。
(4)要将1L氧化浸出液中的硒元素全部还原,需要至少加入Na2SO3_____mol;
(5)滤渣A的主要成分有___________;滤液B的金属阳离子有___________;
(6)处理硒酸泥的另一种方法是往硒酸泥中加入等体积的浓硫酸进行焙烧,本工艺流程与此方法相比主要的优点是(写两点):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度1.18g/mL、质量分数为36.5%的浓盐酸配制250mL0.1mol/L的盐酸,回答下列问题:
(1)配制250mL0.1mol/L的盐酸
应量取的浓盐酸的体积/mL | 应选用的容量瓶的规格/mL | 除容量瓶外需要的其他仪器 |
____ | ____ | ____ |
(2)配制时,正确的操作顺序是____(填编号)。
A.用适量蒸馏水洗涤烧杯和玻璃棒2~3 次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入适量蒸馏水,用玻璃棒搅拌, 使其混合均匀
C.将已冷却的溶液沿玻璃棒注入所选容量瓶中
D.盖好瓶塞,上下颠倒摇匀
E 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm 处
(3)操作A中,将洗涤液都注入容量瓶,其目的是______, 若无操作A,则所配溶液浓度____(填“偏大”、“偏小”或“不变”)
(4)E中加蒸馏水不慎超过了刻度线,则所配溶液浓度____(填“偏大”、“偏 小”或“不变”),应如何处理______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图1是细胞中3种化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是 ( )

A. 若图1表示正常细胞,则甲、乙化合物共有的元素中含量最多的是a
B. 若图l表示细胞完全脱水后化合物含量的扇形图,则甲化合物中含量最多的元素为图2中的b
C. 图2中含量最多的元素是a,这与细胞中含量最多的化合物无关
D. 若图1表示正常细胞,则乙化合物具有多样性,其必含的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易水解、受热易分解的白色固体,某研究小组用下图所示的实验装置制备氨基甲酸铵,反应原理为:2NH3(g)+CO2(g)=H2NCOONH4(s) △H<0。

(1)仪器B的名称是________________。
(2)打开阀门K,装置E中由固体药品所产生的气体就立即进入装置D,则该固体药品的名称为________________。
(3)装置D为制备氨基甲酸铵的反应器(CCl4充当惰性介质),在合适催化剂下搅拌一段时间。
①反应在冰水浴中进行的原因为_______________________________________。
②当CCl4液体中产生较多晶体悬浮物时,即停止反应,__________(填操作名称)分离得到粗产品。
(4)仪器G的作用有:_______________________________________。
(5)该实验装置中有一处不足,改进方法是______________________________________。
(6)已知氨基甲酸铵可完全水解为碳酸氢铵,则该反应的化学方程式_________________。
(7)为测定某样品中氨基甲酸铵的质量分数,某研究小组用该样品进行实验,已知杂质不参与反应,请补充完整测定某样品中氨基甲酸铵质量分数的实验方案(限选试剂:蒸馏水、澄清石灰水、Ba(OH)2溶液):用天平称取一定质量的样品,加水溶解,____________________,测量的数据取平均值进行计算。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二环[1,0,0]丁烷(![]() )是最简单的桥环化合物。下列关于该化合物的说法错误的是
)是最简单的桥环化合物。下列关于该化合物的说法错误的是
A. 该化合物的二溴代物有4种
B. 生成1molC4H10需要2molH2
C. 该化合物与1,3-丁二烯互为同分异构体
D. 该化合物中4个碳原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室根据“侯氏制碱法”原理制备少量NaHCO3:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。其实验包括制取氨气→ 制取NaHCO3→分离NaHCO3→干燥NaHCO3 四个步骤。下列实验必须选用的主要仪器正确的是:

A. 制取氨气,可选用②③
B. 制取NaHCO3,可选用④⑦⑨
C. 分离NaHCO3,可选用④⑤⑥⑦
D. 干燥NaHCO3,可选用②③⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com