
����Ŀ��ij��ѧѧϰС����������´Ӻ������պ�ĺ���������ȡ�ⵥ�ʵ����̣�
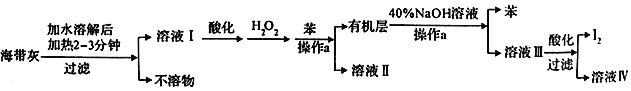
��1���ܽ⺣����ʱҪ�������2��3min��Ŀ����_________________������a������Ϊ ____________��
��2�����ữ����ҺI�м���H2O2��Ŀ��Ϊ__________________________________��
��3����֪I2��40%��NaOH��Һ��Ӧ���ɵ���������ͻ�ԭ��������ʵ���֮��Ϊ1:5��д����Ӧ�Ļ�ѧ����ʽ��________________________________��
��4�������˵õ���I2��Ҫ����ϴ�Ӻ������ϴ�Ӽ�����Ӧ��ѡ�õ���_________����ѡ����ĸ���� A.��ˮ B.�Ҵ� C.��ˮ D.����̼
��5����Na2S2O3�ı���Һ�ⶨ��Ʒ�Ĵ��ȣ�������Ӧ��I2+2Na2S2O3=Na2S4O6+2NaI��ȡ5.0g��Ʒ�����Ƴ�100ml��Һ��ȡ10.00ml��Һ���Ե�����ҺΪָʾ������Ũ��Ϊ0.050mol��L-1Na2S2O3�ı���Һ���еζ���������ݼ�¼���±���ʾ��
��� | 1 | 2 | 3 |
��Һ�����/mL | 10.00 | 10.00 | 10.00 |
����Na2S2O3������Һ�����/mL | 19.95 | 17.10 | 20.05 |
�ζ�ʱ���ﵽ�ζ��յ��������________________���ⵥ���ڲ�Ʒ�е�����������________________���ðٷ�����ʾ���ұ���1λС������
���𰸡� �ӿ�I-�ܽ⣬ʹ��������I-������ȫ���ܽ� ��Һ ��I-����ΪI2 3I2+6NaOH==NaIO3+5NaI+3H2O C �������һ�α���Һ����ɫ��Һǡ�ñ�Ϊ��ɫ���Ұ���Ӳ��ָ� 25.4%
����������1���ܽ⺣����ʱҪ��������Ǽӿ�I-�ܽ⣬ʹ��������I-������ȫ���ܽ⣬����a�Ƿ���ⵥ�ʵ�ˮ��Һ�����뱽��Һ��ȥ�ⵥ�ʷֲ��Һ�õ����ⵥ�ʵ��л��㣬����a������Ϊ��Һ����2�����ữ����ҺI�м���H2O2��Ŀ��Ϊ��I-����ΪI2����3���ⵥ�ʺ�����������Һ��Ӧ�����绯��Ӧ����Ԫ�ػ��ϼ۽���Ϊ-1�۵õ���ԭ�������Ϊ���۵õ����������������ͻ�ԭ��������ʵ���֮��Ϊ1:5����ϵ����غ������ߵĻ��ϼ�Ϊx����1����x-0��=5��[0-(-1)]�����x=+5����Ӧ�Ļ�ѧ����ʽΪ��3I2+6NaOH==NaIO3+5NaI+3H2O����4��I2��Ҫ����ϴ�Ӻ��ϴ�Ӽ�������ⵥ�ʷ�����Ӧ�������ܽ�ⵥ�ʣ���A����ˮ�еⵥ���ܽ�Ƚϴ�ѡ��A��ѡ��B���ⵥ���������Ҵ����������Ҵ�ϴ�ӵⵥ�ʣ�ѡ��B��ѡ��C���ⵥ������ˮ���ܽ��Բ���������ϴ�ӵⵥ�ʣ�ѡ��Cѡ��D���ⵥ�������ڶ���̼����������ϴ�ӵⵥ�ʣ�ѡ��D��ѡ����ѡC����5���Ե�����ҺΪָʾ������Ũ��Ϊ0.050mol��L-1Na2S2O3�ı���Һ���еζ����յ�����Ϊ��ɫ��Һǡ�ñ�Ϊ��ɫ�Ұ�����ڲ���ɫ���������ݿ�֪���ڶ���ʵ�������ı���Һ������������������̫��Ӧ���Dz���ʧ����ȥ����ʵ������Na2S2O3����Һ�������ƽ��ֵΪ![]() =20.00mL������ݷ�Ӧ�ķ���ʽ��֪��
=20.00mL������ݷ�Ӧ�ķ���ʽ��֪��
I2 + 2Na2S2O3 =Na2S4O6+2NaI
1 2
n(I2) 0.0200L��0.05mol/L
������Ʒ��I2�����ʵ�����0.0200L��0.05mol/L��![]() 10=0.005mol����ⵥ���ڲ�Ʒ�е���������=
10=0.005mol����ⵥ���ڲ�Ʒ�е���������=![]() ��100%=25.4%��
��100%=25.4%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���淴ӦmA��g��+nB��g��qC��g����H���ܱ������н��У���ͼ��ʾ�ڲ�ͬʱ��t���¶�T��ѹǿp��B�����ڻ�������е���������գ�B���ı仯����������ƶ�����ȷ���ǣ� ��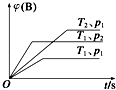
A.p1��p2 �� T1��T2 �� m+n��q����H��0
B.p1��p2 �� T1��T2 �� m+n��q����H��0
C.p1��p2 �� T1��T2 �� m+n��q����H��0
D.p1��p2 �� T1��T2 �� m+n��q����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�ؼס��ҡ�������������Ԫ�����ڱ��е����λ�������ʾ�����ж������������������������������������ش��������⣺
�� | �� | �� | |
�� | �� |
��1������Ԫ�����ڱ��е�λ����___________________��
��2��ԭ�Ӱ뾶����______�ף��>����<������
��3����������ɻ�����ĵ���ʽΪ______�����л�ѧ����������_____������ԡ��Ǽ��ԡ������ۼ���
��4��Ԫ�صķǽ����ԣ���______�����>����<������������ʵ��˵���ý��۵���_______������ĸ����
A�������⻯���ȶ������⻯�ﲻ�ȶ�
B����������������Ӧ��ˮ������ǿ�ᣬ��������
C����������������Ӧ��ˮ����������ˮ��������
��5����ҵ����ȡ�ף���Ʒ���Ļ�ѧ����ʽΪ_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W����ͼ��ʾ��ת����ϵ(��Ӧ�����Ͳ���������Ӧ��ʡ��)����X��Y��Z������

��Na��Na2O��Na2O2 ��A1Cl3��A1(OH)3��NaA1O2
��)Fe��FeCl2��FeCl3 ��NaOH��Na2CO3��NaHCO3
A. �٢ڢ� B. �ڢ� C. �٢ڢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ�����������缫����һ��������Na2SO4��Һ�н��е�⣬ͨ��һ��ʱ����������Ϸų�a mol���壬ͬʱ��w g Na2SO410H2O�������������¶Ȳ��䣬��ʱʣ����Һ�����ʵ���������Ϊ�� ��
A.![]() ��100%
��100%
B.![]() ��100%
��100%
C.![]() ��100%
��100%
D.![]() ��100%
��100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С����ʵ����̽����������泥�NH2COONH4���ֽⷴӦƽ�ⳣ����ˮ�ⷴӦ���ʵIJⶨ��
��1����һ���������İ���������������Ƶ��ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4��s��2NH3��g��+CO2��g����ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶ȣ��棩 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ����ѹǿ��kPa�� | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
ƽ��������Ũ�ȣ���10��3mol/L�� | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
�ٿ����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����������ĸ����
A��2v��NH3��=v��CO2�� B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
�ڸ��ݱ������ݣ�����25.0��ʱ�ķֽ�ƽ�ⳣ��Ϊ ��
��2����֪��NH2COONH4+2H2ONH4HCO3+NH3H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c��NH2COO������ʱ��仯������ͼ��ʾ��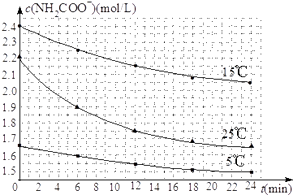
�ۼ���25��ʱ��0��6min���������ˮ�ⷴӦ��ƽ������Ϊ ��
�ܸ���ͼ����Ϣ�����˵��ˮ�ⷴӦ��ƽ���������¶����߶����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��С��ͬѧӵ������ʵ��������
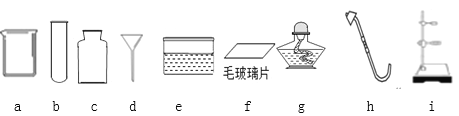
��1��д���������ƣ�c______��
��2��ʵ����������غͶ���������ȡ������
�����������в���Ҫ�õ����ǣ�����ţ�_____��
��������ˮ���ռ������Ĺ����У��жϼ���ƿ�������Ѽ�����������______��
A.����ƿ��ˮλ�½��ˣ�
B.��ˮ���г������ݣ�
C.�������ǵ�ľ�����ڼ���ƿ�ڣ�ľ����ȼ��
��Ҫ�ӷ�Ӧ���ʣ������л��ն������̣���Ҫ���²������裺______��______��ϴ�ӡ���ɡ�
��С���Ƿ�����������ſ������ռ�����______����д�ǻ��
��С������ʵ��������12.25g�������3gMnO2��ϼ��ȣ���ʽ���������Եõ��������ʵ���������____________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com