
| A. | 18 g H2O含有10NA个质子 | |
| B. | 25℃时,PH=13的NaOH溶液中含有的OH- 数目为0.1NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
分析 A.水分子中含10个质子,计算18g水物质的量计算质子数;
B.溶液体积不知不能计算微粒数;
C.标准状况气体摩尔体积为22.4L/mol,氨水是溶液;
D.常温下铁在浓硫酸中钝化不能继续进行;
解答 解:A.水分子中含10个质子,计算18g水物质的量=$\frac{18g}{18g/mol}$=1mol,计算质子数=1mol×10×NA=10NA,故A正确;
B.25℃时,PH=13的NaOH溶液中含有的OH- 溶液浓度为0.1mol/L,溶液体积不知不能计算微粒数,故B错误;
C.标准状况气体摩尔体积为22.4L/mol,氨水是溶液不能计算物质的量,故C错误;
D.常温下铁在浓硫酸中钝化不能继续进行,56 g铁片投入足量浓H2SO4中生成SO2分子远远小于NA个,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的理解应用,主要是微粒数和物质的量的计算、气体摩尔体积条件应用,掌握基础是解题关键,题目难度不大..


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 硅处于金属与非金属的过渡位置,硅可用作半导体材料 | |
| C. | 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
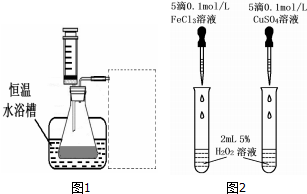
| 所需试剂 | 操作及现象 | 结论 |
| Cl对H2O2分解无催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔现象实验可以区分食盐水和淀粉溶液 | |
| B. | 向氯化铁溶液中加入氢氧化钠溶液来制备Fe(OH)3胶体 | |
| C. | 硅酸铜钡(化学式:BaCuSi2Ox,Cu为+2价) 用氧化物形式表示:BaO•CuO•SiO2 | |
| D. | 某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6,-2 | +5,-3 | -2 |
| A. | GOH溶液和M(OH)3可以相互反应 | B. | 非金属性:T<Q | ||
| C. | 气态氢化物的稳定性:R>T | D. | L2+与T2-核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验事实 | 理论解释 |
| A | 氧化性:HClO>HClO4 | HClO4分子中非羟基氧原子数目较多 |
| B | 沸点:SiO2>CO2 | 相对分子质量越大沸点越高 |
| C | 密度:干冰>冰 | 干冰晶体属于分子密堆积 |
| D | 分解温度:MgO>NaCl | MgO晶格能大于NaCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.
它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:2,2,4-三甲基戊烷;若A是由烯烃和H2通过加成反应得到,则该烯烃的结构简式为CH2=C(CH3)CH2C(CH3)3或(CH3)2C=CH(CH3)3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com