
下列叙述正确的是
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合生成Na2CO3,Na2O2与CO2发生置换生成O2
③Na2O是淡黄色物质,Na2O2是白色物质
④Na2O2可作供氧剂,而Na2O不行
⑤Na2O2和Na2O焰色反应均为黄色
A、都正确 B、②③④⑤ C、②③⑤ D、④⑤
科目:高中化学 来源:2016届甘肃省嘉峪关市高一上学期期中考试化学试卷(解析版) 题型:选择题
100mL0.3mol·L-1Na2SO4溶液和50mL0.2mol·L-1Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度(设体积为二者之和)为( )
A.0.2mol?L-1 B.0.25 mol?L-1 C.0.4 mol?L-1 D、0.5 mol?L-1
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高一上学期期末考试化学试卷(解析版) 题型:选择题
硅及其化合物在材料领域中应用广泛。下列叙述中,正确的是( )。
A.晶体硅是良好的半导体材料
B.硅是地壳中含量最多的元素
C.SiO2不溶于水,也不溶于任何酸
D.用带玻璃瓶塞的试剂瓶盛放NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高一上学期期末考试化学试卷(解析版) 题型:填空题
2016年奥运会将在里约热内卢举行,下图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成。A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3∶4,电子数之比为3∶2。
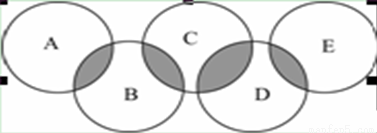
(1) D的化学式为________。
(2)A、B、E中含有一种相同的元素,其名称为________。
(3)B和E反应可生成一种单质和一种常见的液态化合物,写出化学方程式________。
(4)写出C与氢氧化钾溶液反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高一上学期期末考试化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,3.36L NO2和水反应转移的电子数为0.1NA
B.1 molNa2O2与足量的水反应,转移的电子数为2NA
C.在常温常压下,1molFe与1molCl2充分反应,转移的电子数约为3NA
D. 在1 L lmol·L-1的氨水中,含有的NH3与NH3·H2O分子的总数小于1mol
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高一上学期期中考试化学试卷(解析版) 题型:填空题
常温下KMnO4氧化浓HCl的反应方程式如下:2KMnO4 +16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O
(1)用“双线桥法”标明反应中电子转移的方向和数目。
(2)又已知 ,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。
,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。
(3)若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为 mol,产生的Cl2在标准状况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高一上学期期中考试化学试卷(解析版) 题型:选择题
标准状况下,VL氯化氢气体溶解在0.2L水中(水的密度近似为1g/mL)所得溶液的密度为ρg/mL质量分数为ω,物质的量浓度为cmol/L,则下列关系中不正确的是
A.c=1000ρω/365 B.ω=365V/(365V+44800)
C.ω=365c/(1000ρ) D.c=1000Vρ/(365V+224000)
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高一上学期期中考试化学试卷(解析版) 题型:填空题
(1)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。 现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
①该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是_______。
②写出一个包含上述七种物质的氧化还原反应方程式(不需配平) ___________。
③上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
④如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:___________________________________________________________________。
(2)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。
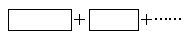
反应中,被还原的元素是________,氧化产物是______________。
②纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂的物质的量之比为________。
(3)一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗3.2 g CH3OH转移0.6 mol电子,则氧化产物为(填化学式),氧化产物与还原产物的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省宜昌市协作体高一上学期期末化学试卷(解析版) 题型:选择题
下列物品所用材料为硅酸盐的是
A.水晶镜片 B.陶瓷餐具 C.石英光导纤维 D.计算机芯片
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com