
| A. | B的消耗速率与B的生成速率相等 | |
| B. | 单位时间内消耗3a mol C,同时生成a mol A | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的密度不再变化 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.B的消耗速率与B的生成速率相等,即正逆反应速率相等,反应达到平衡状态,故A正确;
B.无论反应是否达到平衡状态,都存在单位时间内消耗3a mol C,同时生成a mol A,不能据此判断平衡状态,故B错误;
C.反应前后气体的计量数之和不变,则恒温恒容条件下,无论反应是否达到平衡状态,容器内压强始终不变,不能据此判断平衡状态,故C错误;
D.反应前后气体的总质量不变,容器体积不变,则容器内气体密度始终不变,不能据此判断平衡状态,故D错误;
故选A.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,也可以根据反应速率判断但反应方向必须相反,题目难度不大.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
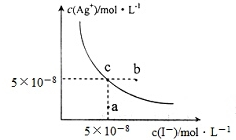
| A. | 在t℃时,Agl的Ksp=2.5×10-15 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?Agl(s)+Br-(aq)的平衡常数K=200 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
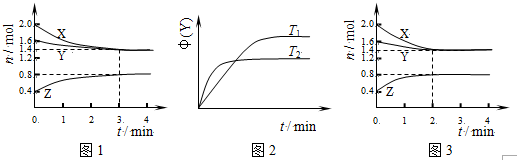
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | 保持其他条件不变,升高温度,反应的化学平衡常数K减小 | |
| D. | 其它条件不变,使用催化剂,则反应进程可能如图3所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
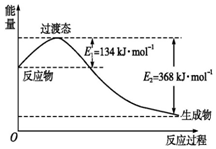 写出下列反应的热化学方程式
写出下列反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到紫色石蕊试液中 | 氯水中不仅有H+还有HClO | |
| ③ | 将氯水滴加到淀粉-KI试纸上 | 淀粉-KI试纸变蓝 (I2遇淀粉变蓝) | 氯水中有Cl2 |
| ④ | 将足量的氯水滴加到NaHCO3溶液中 | 有气泡生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液 | B. | 悬浊液 | C. | 乳浊液 | D. | 胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:1 | B. | 10:1 | C. | 1:10 | D. | 9:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2CH3OH(1)+3O2(g)═2CO2(g)+2H2O(g)△H=-1478KJ/mol,则CH3OH(1)的燃烧热为739KJ/mol | |
| B. | 若P4(白磷,s)═4P(红磷,s)△H<0,则红磷比白磷稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.3KJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.65KJ的热量 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;△H1>△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com