
【题目】已知![]() 。
。![]() 时,
时,![]() 和
和![]() 的饱和溶液中,金属阳离子的物质的量浓度的负对数
的饱和溶液中,金属阳离子的物质的量浓度的负对数![]() 与溶液pH的变化关系如图所示。下列说法正确的是
与溶液pH的变化关系如图所示。下列说法正确的是
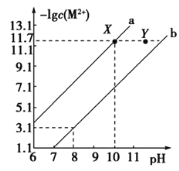
A.向等浓度的![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液,
溶液,![]() 先沉淀
先沉淀
B.当![]() 和
和![]() 沉淀共存时,溶液中:
沉淀共存时,溶液中:![]()
C.Y点对应的![]() 分散系是不稳定的体系
分散系是不稳定的体系
D.通过直接控制pH的方法可除去![]() 溶液中含有的量
溶液中含有的量![]()
【答案】C
【解析】
Ksp[Cu(OH)2]<Ksp[Fe(OH)2],则Fe(OH)2的溶解度大于Cu(OH)2,则![]() 相等时,Fe(OH)2中氢氧根离子的浓度大于Cu(OH)2中氢氧根离子的浓度,所以曲线a表示Cu(OH)2、曲线b表示Fe(OH)2,据此分析解答。
相等时,Fe(OH)2中氢氧根离子的浓度大于Cu(OH)2中氢氧根离子的浓度,所以曲线a表示Cu(OH)2、曲线b表示Fe(OH)2,据此分析解答。
A.向等浓度的![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液,溶度积小的先沉淀,应先生成氢氧化铜沉淀,故A错误;
溶液,溶度积小的先沉淀,应先生成氢氧化铜沉淀,故A错误;
B.pH=8时,-lgc(Fe2+)=3.1,Ksp[Fe(OH)2]=10-3.1×(10-6)2=10-15.1,当pH=10时,-lgc(Cu2+)=11.7,则Ksp[Cu(OH)2]=10-11.7×(10-4)2=10-19.7,c(Fe2+)∶c(Cu2+)=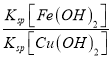 =
=![]() =
=![]() ,故B错误;
,故B错误;
C.Y点对应的Cu(OH)2分散系中,c(Cu2+)×c2(OH-)>Ksp[Cu(OH)2],平衡逆向移动,形成沉淀,即Y点对应的Cu(OH)2分散系是不稳定的体系,故C正确;
D.氢氧化铜溶度积较小,调节pH,先生成氢氧化铜沉淀,不能通过直接控制pH的方法可除去![]() 溶液中含有的量
溶液中含有的量![]() ,故D错误;
,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】以熔融的碳酸盐(K2CO3)为电解液,泡沫镍为电极,氧化纤维布为隔膜(仅允许阴离子通过)可构成直接碳燃料电池,其结构如图所示,下列说法正确的是
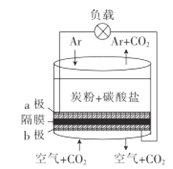
A.该电池工作时,CO32-通过隔膜移动到a极
B.若a极通入空气,负载通过的电流将增大
C.b极的电极反应式为2CO2+O2-4e- =2CO32-
D.为使电池持续工作,理论上需要补充K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=QkJ·mol1(Q>0)。下列说法正确的是( )
2SO3(g) ΔH=QkJ·mol1(Q>0)。下列说法正确的是( )
A.相同条件下,2molSO2(g)和1molO2(g)所具有的能量小于2molSO3(g)所具有的能量
B.将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,放出热量为QkJ
C.对于指定可逆反应的ΔH,表示达到平衡状态时的热量变化
D.如一定量SO2(g)和O2(g)置于某密闭容器中充分反应放热QkJ,则此过程中2molSO2(g)被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为:

下列说法不正确的是
A. M的分子式为C6H12O6 B. N的结构简式为CH3COOH
C. ④的反应类型属于取代反应 D. 淀粉与纤维素互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:
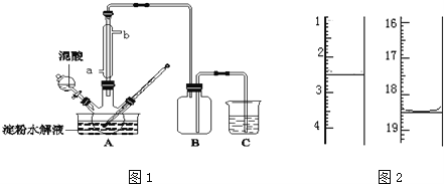
①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸H2A在水中发生电离:H2A=H++HA-,HA-![]() H++A2-。下列叙述中不正确的是
H++A2-。下列叙述中不正确的是
A.在NaHA溶液中c(Na+)>c (HA-)> c(H+) >c (OH-)
B.在Na2A溶液中c (Na+)=2c (A2-)+2c(HA-)+2c (H2A)
C.在Na2A溶液中c (OH-) =c (HA-)+ c (H+)
D.在H2A溶液中c (H+)=c (HA-)+2c (A2-)+c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
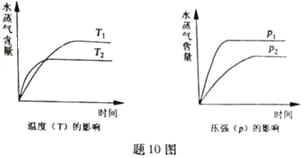
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理处理燃气中的H2S,不仅可减少对大气的污染,还可进行资源化利用。回答下列问题:
(1)H2S和S的燃烧热如表所示,
物质 | 燃烧热/△H(kJmol-1) |
H2S | -a |
S | -b |

请写出常温下H2S与SO2反应的热化学方程式______。
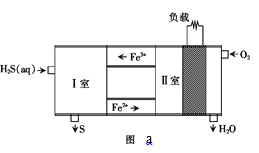
(2)可以把H2S设计为一种燃料电池,原理如图a所示:其中,Fe2+在电池工作中的作用是______;请写出 I室发生的离子方程式______。
(3)为探究H2S的直接热解2H2S(g)=2H2(g )+S2(g)。在一体积为2L的密闭容器中充入2 mol H2S与1 molAr (起到稀释作用),进行实验。
①某同学测出不同温度下H2S的物质的量与反应时间的图象,图b是截取该图象的中间某部分。请计算T2温度下,0-l0s内,H2S的反应速率v=______moL-1s-1;
②图b中,T1、T2、T3三个温度,最高的是______;比较A点与B点的逆反应速率的大小,vA(逆)______vB(逆)(填“>”、“<”或“=”);
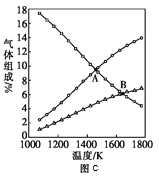
③图c是表示反应2H2S(g)=2H2(g)+S2(g)平衡时,装置内各组分气体物质的量分数=与温度的关系(其中Ar气体变化曲线未画出)。请计算:C点的平衡常数K=______;D点平衡时,H2S的转化率=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com