
| 35Cl | 34.969 | 75.77% | 35Cl | 35 | 75.77% |
| 37Cl | 36.969 | 24.23% | 37Cl | 37 | 24.23% |
| 平均 | 35.453 | 平均 | 35.485 | ||
科目:高中化学 来源: 题型:实验题
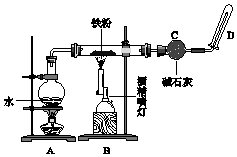 完成实验Fe与水蒸气反应,如图所示.
完成实验Fe与水蒸气反应,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| C. | NaHCO3溶液中溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 室温下,对于0.10 mol•L-1的氨水,加水稀释后,溶液中c(NH4+)•c(OH-)变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
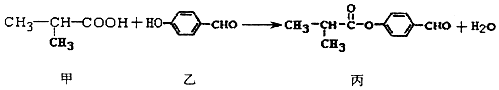
| A. | 丙的分子式为C11H11O3 | |
| B. | 甲分子中含有1个手性碳原子 | |
| C. | 乙、丙各lmol分别和氢气反应,最多消耗氢气均为4mol | |
| D. | 丙可发生加成反应、取代反应、氧化反应等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 NaHNa+[:H]- CsOH
NaHNa+[:H]- CsOH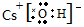 HSCN
HSCN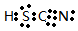 O22-
O22- .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
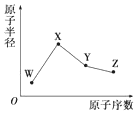 W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
W、X、Y、Z是4种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )| A. | X的非金属性是同周期中最强的 | |
| B. | 对应气态氢化物的稳定性:Y>Z | |
| C. | 对应简单离子半径:X>W | |
| D. | Y的氧化物能与X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验装置 | 实验现象 |
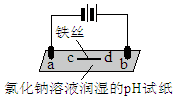 | a处试纸变蓝; b处变红,局部褪色; c处试纸变蓝; d处无明显变化 |
| A. | a为电解池的阴极 | |
| B. | b处有氯气生成,且与水反应生成了盐酸和次氯酸 | |
| C. | d处发生了反应:Fe-3e-=Fe3+ | |
| D. | c处:2H2O+2e-=H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化是,c(I-):c(Br-)═1:1 | |
| D. | 当a=0.28时,4Fe2++10I-+7Br2═4Fe3++5I2+14Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com