
【题目】重水(D2O)是重要的核工业原料,下列说法错误的是( )
A. 1mol D2O含有10NA个电子 B. 1H与D互称同位素
C. H2O与D2O互称同素异形体 D. 1H→D通过化学变化不能实现
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 ,分析其结构,并回答下列问题:
,分析其结构,并回答下列问题:
(1)写出其分子式:____________________________________________。
(2)其中含有____个不饱和碳原子,分子中有____个双键。
(3)分子中的极性键有__________(写出2种即可)。
(4)分子中的饱和碳原子有______个,一定与苯环处于同一平面的碳原子有______个。
(5)分子中C—C===O键角约为__________,H—C≡C键角约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:2X(g)+Y(g)2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示:下列判断正确的是( )
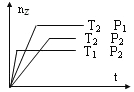
A. P1>P2 T1>T2 ΔH<0B. P1>P2 T1<T2 ΔH<0
C. P1>P2 T1>T2 ΔH>0D. P1<P2 T1<T2 ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 是五种短周期元素,其中A、B、C 在同一周期。0.5molA 元素的原子失去9.03×1023 个电子后,转化为具有与氖原子相同电子层结构的离子,A 元素最高价氧化物的水化物能分别与B、C 元素最高价氧化物的水化物反应,且都生成盐,B 元素原子各层电子数均为偶数,C 元素原子最外层电子数比最内层少一个。D 元素的一种同位素原子中没有中子。E 元素与其它四种元素均不在同一周期,E 的最高价氧化物的水化物是一种强酸。请回答下列问题:
(1)A 离子结构示意图为:_____;E 元素在周期表中的位置是_____;
(2)用电子式表示B 与C 形成化合物的过程:_____;
(3)A 元素最高价氧化物的水化物与 C 元素最高价氧化物的水化物反应的离子方程式是:_____;
(4)E 与D 形成的某种化合物,其水溶液呈碱性,其原因是_____(用离子方程式作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g)在0.5 L密闭容器中进行,0.5 min后,A减少了0.90 mol,则反应的速率可表示为( )
4C(g)+6D(g)在0.5 L密闭容器中进行,0.5 min后,A减少了0.90 mol,则反应的速率可表示为( )
A. v(A)=3.6mol·L-1·s-1B. v(B)=0.030 mol·L-1·s-1
C. v(C)=0.03 mol·L-1·s-1D. v(D)=0.09 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1) 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________。
(2) 碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃; ③____________________________。
(3) 若pH过高,则对产品的影响是_________________________。
(4) 为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下)。在所得溶液中加过量氨水,得到白色沉淀,经过滤、洗涤沉淀、充分灼烧得到1.02g固体。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于第ⅠA族和第ⅦA族元素的说法正确的是( )
①第ⅠA族元素都是金属元素
②第ⅠA族元素都能形成+1价的离子
③第ⅦA族元素的最高正价都为+7
④第ⅦA族元素简单气态氢化物的热稳定性逐渐减弱
A. ①③ B. ②③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. H2O、D2O和T2O三者中H、D、T互为同位素,所以这三者不是同一种物质
B. 正丁烷和异丁烷,白磷和红磷互为同分异构体
C. 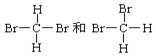 不是同分异构体
不是同分异构体
D. H2O 、Ne 和H2SO4都是只含共价键而不含离子键的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,流程如下:

(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为 。能提高烧渣浸取速率的措施有 (填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是 (填字母)。

A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有 。
(3)滤渣Ⅱ主要成分的化学式为 ;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是 、 过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com