
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: |
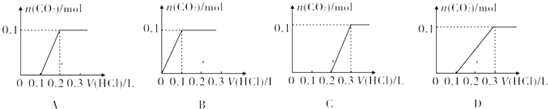
分析 (1)二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,二氧化碳恰好反应得到碳酸钠溶液,二氧化碳不足溶液中溶质为碳酸钠和氢氧化钠,当二氧化碳过量时,碳酸钠也会与二氧化碳反应;
(2)①要验证NaOH和Na2CO3同时存在,根据题中所给试剂,要首先利用中性溶液BaCl2检验出碳酸钠,并将碳酸根离子全部沉淀,再通过检验溶于的pH来确定是否含有NaOH;
②对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答.
解答 解:(1)二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,二氧化碳恰好反应得到碳酸钠溶液,二氧化碳不足溶液中溶质为碳酸钠和氢氧化钠,当二氧化碳过量时,碳酸钠也会与二氧化碳反应,Na2CO3+CO2+H2O=2NaHCO3 ,可以得到溶液中的溶质为NaOH与CO2反应可生成Na2CO3或NaHCO3,或NaHCO3,所以白色固体可能为NaOH和Na2CO3、Na2CO3、NaHCO3、Na2CO3 和NaHCO3,
故答案为:NaOH和Na2CO3、Na2CO3、NaHCO3、Na2CO3 和NaHCO3;
(2)向300mL 1mol/L的NaOH溶液中通入一定量CO2,当通入标准状况下CO2的体积为2.24L时,
n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.3L×1mol/L=0.3mol,
CO2+2NaOH=Na2CO3+H2O
1 2 1
0.1mol 0.2mol 0.1mol
此时氢氧化钠过量,得到溶液中Na2CO3质量=0.1×106g/mol=10.6g,NaOH的质量=(0.3mol-0.2mol)×40g/mol=4g,
①要验证NaOH和Na2CO3同时存在,根据题中所给试剂,要首先利用中性溶液BaCl2检验出碳酸钠,并将碳酸根离子全部沉淀,再通过检验溶于的pH来确定是否含有NaOH,
步骤1:取少量白色固体于试管中,加适量水溶解,再加0.5moL•L-1BaCl2溶液至过量,产生白色沉淀,说明固体中含有Na2CO3;
步骤2:过滤,取少量滤液(或:静置,用胶头滴管取上层清液少许)于试管中,再向试管中滴加1~2滴酚酞试液,溶液变红色,说明固体中含有NaOH,
故答案为:4 g NaOH和10.6 g Na2CO3
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量白色固体于试管中,加足量水溶解,再加足量0.5 mol•L-1 BaCl2溶液 | 产生白色沉淀,说明白色固体中含有Na2CO3 |
| 步骤2:过滤,取2 mL滤液于试管中,再向试管中滴加酚酞试液 | 溶液变红色,说明白色固体中含有NaOH |
点评 本题考查较为综合,以物质的制备实验为载体,综合考查实验的设计、物质的分离、提纯等知识,注意根据物质的性质设计实验方案,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA | |
| B. | 标准状况下,22.4LNO与CO2的混合气体中含有O原子数为3NA | |
| C. | 58.5 g的NaCl固体中含有NA个氯化钠分子 | |
| D. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| T/℃ | 400 | 300 |
| 平衡常致K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质谱法是测定有机物所含官能团的常用方法 | |
| B. | 红外光谱常用来测定有机物所含几种类型的氢原子 | |
| C. | 核磁共振氢谱可以区别乙醇与甲醚 | |
| D. | 红外光谱不能分别乙醇和甲醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3)(4)(5)(8) | B. | (4)(5)(7)(8) | C. | (4)(5)(8) | D. | (3)(4)(5)(7)(8) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com