
基态硼原子的电子排布式为
________________________________________________________________________。
科目:高中化学 来源: 题型:
下列说法正确的是( )
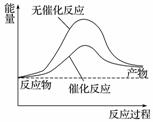
A.右图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g)
ΔH=-a kJ·mol-1,
Ⅱ: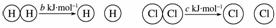
且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为 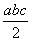 kJ
kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
0.1 mol·L-1某碱AOH溶液的pH=11,将该溶液稀释10倍后,溶液的pH不可能为( )
①10.1 ②10.8 ③12 ④11.5
A.③④ B.①②
C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
根据信息回答下列问题:
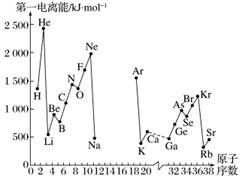
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第三周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______<Al<______(填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是________________。
(3)信息A图中第一电离能最小的元素在周期表中的位置是________周期________族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有________性,其中Be(OH)2显示这种性质的离子方程式是________________________________________________________________________。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围________________。
(6)请归纳元素的电负性和金属性、非金属性的关系是________________。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物,说出理由并写出判断的方法________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于1s、2s、3s、4s原子轨道的说法,正确的是 ( )
A.电子只能在电子云轮廓图中运动
B.能级不同,电子云轮廓图形状相同
C.轨道数目相同,电子云轮廓图形状、大小完全相同
D.能层不同,电子云轮廓图形状也不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关σ键和π键的说法错误的是( )
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时,只能形成σ键,不能形成π键
D.在分子中,化学键可能只有π键而没有σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列关于电解质溶液的判断正确的是( )
A.在pH=12的溶液中,K+、Cl-、HCO 、Na+可以大量共存
、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO 、SO
、SO 、K+可以大量共存
、K+可以大量共存
C.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液中存在BOH===B++OH-
D.由0.1 mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液中存在A-+H2O??HA+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com