
下图所示装置中发生反应的离子方程式为:Zn + 2H+=Zn2+ + H2↑,下列说法错误的是

A.a、b不可能是同种材料的电极
B.该装置可能是电解池,电解质溶液为稀盐酸
C.该装置可看作是铜一锌原电池,电解质溶液是稀硫酸
D.该装置中通过2 mol电子,生成的气体在标况下的体积为22.4L
A
【解析】
试题分析:若a与电源正极相连,b与电源负极相连,稀硫酸为电解液,则a、b可以都是锌电极,则阳极反应式为Zn—2e-=Zn2+,阳离子移向阴极,氢离子比锌离子容易得到电子,则阴极反应式为2H++2e-=H2↑,故A错误;该装置可能是电解池,锌作阳极,稀盐酸为电解液,则阳极反应式为Zn—2e-=Zn2+,阴极反应式为2H++2e-=H2↑,故B正确;若为铜锌原电池,稀硫酸为电解质溶液,由于锌比铜活泼,则锌是负极,铜是正极,则负极反应式为Zn—2e-=Zn2+,阳离子移向正极,氢离子比锌离子容易得到电子,则正极反应式为2H++2e-=H2↑,故C正确;由于Zn+2H+=Zn2++H2↑~2e-中各物质的系数之比等于物质的量之比,则该装置中通过2mol电子时生成的氢气的物质的量为1mol,标准状况下用n=V/Vm求得氢气的体积为22.4L,故D正确。
考点:考查电化学,涉及总反应式、电极材料、电解质溶液、电解池、原电池、电极反应式、电极产物与转移电子之间关系的应用等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解

【实验探究】
(1)探究浓硝酸的强氧化性
将过量铜片置于具支试管的底部,通过分液漏斗往具支试管中加入少量浓硝酸,用排水法收集产生的气体。
①在具支试管中观察到实验现象是__________________________________。
②具支试管中发生反应的化学方程式为:____________________________。
(2)探究稀硝酸的强氧化性
①上述反应完成后,欲进一步探究稀硝酸的强氧化性,紧接着简便、合理的实验操作是:
________________________________________________________。
②能证明稀硝酸与铜反应的还原产物为NO的实验现象是______________(填标号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
【实验反思】
(1)某同学提出,实验过程中若操作不慎,易出现倒吸现象。对该实验装置进行改进的方案是:可在b与c之间连接____________________________(填装置的名称)。
(2)利用该装置先进行铜与浓硝酸的反应,再进行铜与稀硝酸反应的实验顺序的合理性是:
_____________________________________________________________________。
【问题讨论】
在用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)分别反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。针对此现象,同学们进行讨论,提出两种意见:
①认为两溶液所显颜色不同的原因,是因为Cu2+浓度的差异引起的。
②认为前者溶液呈绿色是因为生成的红棕色NO2气体溶解于溶液中引起的。
你认为上述意见______________(填“①”或“②”)合理。(注:若选填①,下题中只答Ⅰ;若选填②,下题中只答Ⅱ)Ⅰ.如果你认为合理,理由是____________________________。
Ⅱ.如果你认为合理,请设计一个简单的实验进行验证:____________________________。
查看答案和解析>>
科目:高中化学 来源:2014届河北省高三调研考试理综化学试卷(解析版) 题型:填空题
工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
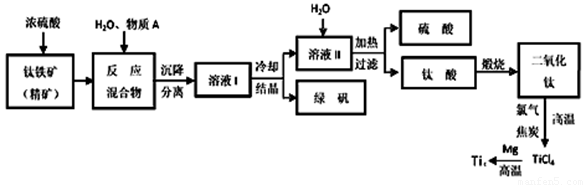
回答下列问题:
(1)钛铁矿和浓硫酸反应属于______________________ (选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_______________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g) ΔH1 = -72 kJ•mol-1
TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g) ΔH2 =+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g) ΔH3 =+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。①写出阳极所发生反应的电极反应式:________________________________。

②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) 。
查看答案和解析>>
科目:高中化学 来源:0118 期末题 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:
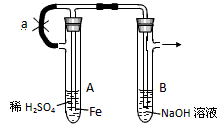
根据下图实验装置和操作,回答有关问题:
按下图所示装置进行实验,观察B中现象。

操作(1):先夹止水夹a,使A管开始反应。在B管中观察到的现象
,B中发生的主要的化学反应有2NaOH + H2SO4 == Na2SO4 + 2H2O,还有
, 。
操作(2):打开止水夹a,使A管开始反应一段时间后再夹紧a,实验中在B管中观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)根据什么现象可以判断铜跟浓硫酸反应有SO2生成________________________。
根据什么现象可以判断铜跟浓硫酸反应有硫酸铜生成_________________________。
写出甲装置中发生的主要反应的化学方程式:_______________________________。
(2)你在实验室中进行这个实验时,除了(1)小题中提到的实验现象外,还可以观察到许多其他的实验现象,请写出两种________________________________________________。
(3)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com