
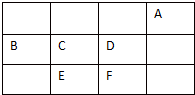
 短周期中三元素A、B、C、D、E、F在周期表中的位置如图,下列有关这六种元素的叙述正确的是( )
短周期中三元素A、B、C、D、E、F在周期表中的位置如图,下列有关这六种元素的叙述正确的是( )| A. | E的氢化物的沸点比C的氢化物的沸点低 | |
| B. | F的最高价氧化物的水化物是一种弱酸 | |
| C. | D的氢化物很稳定,因为它含有氢键 | |
| D. | B、C、D原子半径依次递增 |
分析 A、B、C、D、E、F位于短周期,则A只能为He,结合各元素在元素周期表中的相对位置可知:B为N元素、C为O元素、D为F元素、E为S元素、F为Cl元素,据此结合元素周期律知识进行解答.
解答 解:A、B、C、D、E、F位于短周期,则A只能为He,结合各元素在元素周期表中的相对位置可知:B为N元素、C为O元素、D为F元素、E为S元素、F为Cl元素,
A.C为O、E为S元素,氢化物分别为水、硫化氢,水分子中存在氢键,导致水的沸点大于硫化氢,故A正确;
B.F为Cl元素,其最高价氧化物为高氯酸,高氯酸为酸性最强的酸,故B错误;
C.氢化物的稳定性是化学性质,氢键只影响物理性质,故C错误;
D.B、C、D分别为N、O、F,位于同一周期,原子序数逐渐增大,原子半径依次减小,故D错误;
故选A.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期表结构为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,C为易错点,注意水分子中存在氢键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃是难溶于水,比水重的液体 | |
| B. | 所有卤代烃在适当条件下都能发生消去反应 | |
| C. | 所有卤代烃都含有卤素原子 | |
| D. | 所有卤代烃都是通过取代反应制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P、S、Cl三种元素的最高价氧化物对应水化物酸性依次增强 | |
| B. | Na、Mg、Al三种元素的原子半径依次减小 | |
| C. | F、Cl、Br三种原子的核外电子层数依次增多 | |
| D. | 、N、O、F三种元素的非金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)为了做到合理营养,我国营养学家将食物分为A、B、C、D、E五类,请回答下列问题:①营养学家将这五类形象地设计成图示的“平衡膳食宝塔”,并提倡居民每天均衡地吃这五类食物.为保证身体健康,建议在每日摄入的总能量中,早、中、晚餐的能量比例是3:4:3.
(1)为了做到合理营养,我国营养学家将食物分为A、B、C、D、E五类,请回答下列问题:①营养学家将这五类形象地设计成图示的“平衡膳食宝塔”,并提倡居民每天均衡地吃这五类食物.为保证身体健康,建议在每日摄入的总能量中,早、中、晚餐的能量比例是3:4:3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
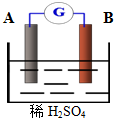 如图为原电池装置:
如图为原电池装置:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①或② | B. | 只有②或④ | ||
| C. | 只有①或②或③ | D. | 上述四种物质中任意一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com