
| C(I-)/(mol•L-1) | C(Fe3+)/(mol•L-1) | ν/(mol•(L•s)-1) | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
分析 (1)反应速率v=$\frac{△c}{△t}$,先计算I2速率,反应速率之比等于化学方程式计量数之比计算得到Fe3+表示的反应速率;
(2)若c(HI)由0.1mol/L 降到0.07mol/L时,需要15s,即减少0.03mol/L需要15s;c(HI)由0.07mol/L 降到0.05mol/L时,浓度减少0.02mol/L,当速率与浓度变化成正比时,需要10s,但浓度越小,化学反应速率越小,需要的时间就长,以此来解答;
(3)将表中的三组数据代入公式v=k[c(I-)]m•[c(Fe3+)]n得m和n的值;
(4)依据(3)计算得到数值判断对反应速率的影响大小.
解答 解:(1)测得2min内生成I2的物质的量浓度为0.02mol/L,v(I2)=$\frac{0.02mol/L}{2min}$=0.01mol/L•min,则用Fe3+表示该反应在这2min内平均反应速率v(Fe3+)=2v(I2)=0.02 mol•L-1•min-1,
故答案为:0.02 mol•L-1•min-1;
(2)若c(HI)由0.1mol/L 降到0.07mol/L时,需要15s,即减少0.03mol/L需要15s;
c(HI)由0.07mol/L 降到0.05mol/L时,浓度减少0.02mol/L,
当速率与浓度变化成正比时,需要$\frac{0.02mol/L}{0.03mol/L}$×15s=10s,
但浓度越小,化学反应速率越小,需要的时间就长,
所以需要时间大于10s,
故答案为:大于;
(3)将表中的三组数据代入公式v=k[c(I-)]m•[c(Fe3+)]n
得0.20m×0.80n=0.032K,
0.60m×0.40n=0.144K,
0.80m×0.20n=0.128K,
解之得:m=2,n=1,
故答案为:C;
(4)上述计算和速率方程可知,I-浓度对反应速率的影响大,I-物质的量浓度对反应速率的影响大于Fe3+物质的量浓度对反应速率的影响,
故答案为:大于.
点评 本题考查了了化学平衡常数、反应速率概念的计算,注意对表格中数据的处理,掌握基础是关键,题目难度中等.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL 蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
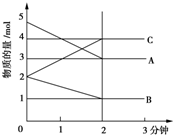 某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体),该反应的化学方程式为2A+B?2C.
某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体),该反应的化学方程式为2A+B?2C.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,原子半径从大到小(稀有气体除外)发生周期性变化 | |
| C. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| D. | 元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl | B. | NaF | C. | Na2O | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
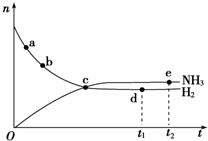 氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为:
氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为: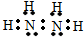 该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O.
该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com