
【题目】实验室研究某些气体的性质可用如图所示装置,下列过程和结论均正确的是

项选 | X | Y | Z | 结论 |
A | Br2 | 苯 | NaOH 溶液 | 苯与溴发生取代反应 |
B | SO2 | 酸性KMnO4溶液 | NaOH 溶液 | 二氧化硫具有漂白性 |
C | HCl | Na2SiO3溶液 | NaCl 溶液 | Cl 的非金属性强于Si |
D | CH2= CH2 | Br2 的CCl4溶液 | AgNO3溶液 | 乙烯与Br2发生加成反应 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为__________洪特规则内容_____________
泡利不相容原理内容______________________
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)__________I1(Cu)(填“大于”或“小于”)。原因是__________
(3)ZnF2具有较高的熔点(872℃ ),其化学键类型是__________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是__________
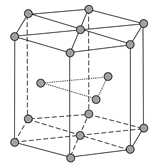
(4)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为__________,配位数为____六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为__________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知反应:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-99kJ·mol-1,在V2O5存在时的反应机理为:①V2O5+SO2→V2O4·SO3(快),②V2O4·SO3+
SO3(g) △H=-99kJ·mol-1,在V2O5存在时的反应机理为:①V2O5+SO2→V2O4·SO3(快),②V2O4·SO3+![]() O2→V2O5+SO3(慢)。下列说法错误的是
O2→V2O5+SO3(慢)。下列说法错误的是
A.对总反应的速率起决定性的是反应②
B.将1molSO2(g)、0.5molO2(g)置于密闭容器中充分反应,放出热量99kJ
C.V2O4·SO3是该反应的中间产物,它与O2的碰撞仅部分有效
D.V2O5是该反应的催化剂,加V2O5可提高单位时间内SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩拜单车可利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C![]() Li1-xCoO2+LixC6,结构如图所示,下列说法错误的是
Li1-xCoO2+LixC6,结构如图所示,下列说法错误的是
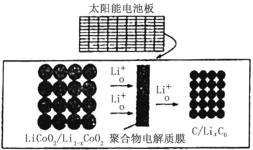
A.充电时,阴极质量增加,发生还原反应
B.充电时,电路中每有1mol电子转移,则有1molLi+由左向右通过聚合物电解质膜
C.该锂离子电池工作时,化学能转化为电能
D.放电时,正极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的关系:
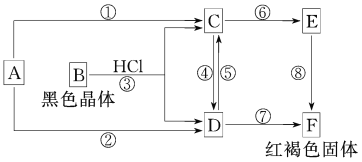
(1)确定A、B、C、D、E、F的化学式:A____________,B____________,C____________,D____________,E____________,F____________。
(2)写出⑧的化学方程式________,④、⑤的离子方程式________,_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前Haber-Bosch法是工业合成氨的主要方式,其生产条件需要高温高压。为了有效降低能耗,过渡金属催化还原氮气合成氨被认为是具有巨大前景的替代方法。催化过程一般有吸附—解离—反应—脱附等过程,图示为N2和H2在固体催化剂表面合成氨反应路径的势能面图(部分数据略),其中“*”表示被催化剂吸附。
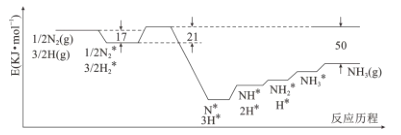
(1)氨气的脱附是____过程(填“吸热”或“放热”),合成氨的热化学方程式为_____
(2)合成氨的捷姆金和佩热夫速率方程式为 w= k1 p(N2)![]() -k2
-k2![]() ,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H22NH3的平衡常数Kp=_________(用k1,k2表示)(注:Kp用各物质平衡分压来表示)。
,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H22NH3的平衡常数Kp=_________(用k1,k2表示)(注:Kp用各物质平衡分压来表示)。
(3)若将2.0molN2和6.0molH2通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2温度下n(H2)的变化,曲线B表示T1温度下n(NH3)的变化,T2温度下反应到a点恰好达到平衡。
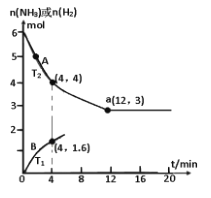
①温度T1___T2 (填“>”、“<”或“=”下同),T1温度下恰好平衡时,曲线B上的点为b(m, n ),则m___12,n__2。
②T2 温度下,反应从开始到恰好平衡时平均速率v(N2) =_____。
③T2温度下,合成氨反应N2+3H22NH3的平衡常数的数值是____;若某时刻,容器内气体的压强为起始时的80%,则此时v(正)____v(逆)(填“>”、“<”或“=”)。
(4)工业上通过降低反应后混合气体的温度而使氨气分离出来。这种分离物质的方法, 其原理类似于下列方法中的___(填序号)。
A.过滤 B.蒸馏 C.渗析 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬渣是生产金属铬和铬盐过程中产生的工业废渣,其中含有Na2SO4及少量Cr2O72—、Fe3+。从铬渣中提取Na2SO4的工艺流程:
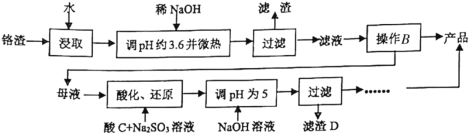
已知:常温时,Fe3+、Cr3+完全沉淀时c≤1×10-5mol·L-1,Ksp[Fe(OH)3]=4×10-38,Ksp[Cr(OH)3]=6×10-31。
(1)调pH约为3.6目的是_________。
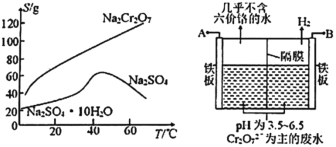
(2)根据下图溶解度(S)—温度(T)曲线,判断操作B为蒸发浓缩、_________________。
(3)“酸化、还原”步骤反应的离子方程式为_______________________________。
(4)滤渣D为________________________(填化学式)。
(5)如图,某工厂采用电解法处理含铬废水,用铁板作阴阳极,槽中盛放含铬废水,A接电源的_______极;阳极区溶液中发生的氧化还原反应为__________________。若不考虑气体的溶解,当收集到6.72L(标准状况)的H2时,理论上有___molCr2O72—被还原。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某物质X能发生如图转化(四种物质均含元素R),回答下列问题:

I.已知常温下Z为一种淡黄色固体,A的水溶液能与铝反应产生氢气,则:
(1)单质X的化学式为_________,工业上Z可以用于____________。(任写一种用途)
(2)A的水溶液与铝反应的离子方程式为_______________________________。
II.若X为一种常见金属单质,白色物质A在空气中易转化为红褐色。则:
(1)Z加入酸性KMnO4溶液中,溶液由紫色褪至无色,说明Z具有________性(填“氧化”、“还原”或“漂白”)。
(2)实验室制备A常会变质,检验其可能变质的方法是将其溶于足量的稀硫酸,然后加入试剂___________,为了较长时间观察A的颜色,可采取的措施有____________。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙醇、乙酸都可以看成是乙烷分子中的氢原子被羟基或羧基取代后的产物
B.下列分子式C2H6O、CF2Cl2、C2H4O2均可表示一种纯净物
C.C4H9OH属于醇的同分异构体的数目与C5H10O2属于羧酸的同分异构体的数目相同
D.有机物![]() 和
和![]() 的一溴取代物的同分异构体数目相同
的一溴取代物的同分异构体数目相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com