
【题目】辣椒素是辣椒的活性成分,可在口腔中产生灼烧感,能够起到降血压和胆固醇的功效,进而在很大程
度上预防心脏病,也能缀解肌肉关节疼痛。辣椒素酯类化合物的结构可以表示为:
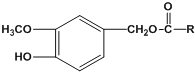
其中一种辣椒素脂类化合物J的合成路线如下:
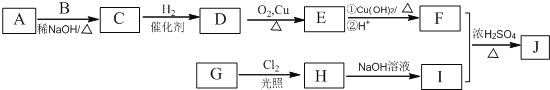
已知:①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰
②J的分子式为C15H22O4
③![]()
回答下列问题:
(1)G所含官能团的名称为_______________________。
(2)由A和B生成C的化学方程式为___________________。
(3)由C生成D的反应类型为____________,D的化学名称为________________。
(4)由H生成I的化学方程式为_______________________。
(5)在G的同分异构体中,苯环上的一氯代物只有种的共有_____种(不含立体异构),其中核磁共振氢谱显示两组峰的是__________(写结构简式)。
(6)参照上述路线,设计一条以乙醛为原料(无机试剂任选)合成乙酸正丁酯的路线:__________。
【答案】 醚键、(酚)羟基 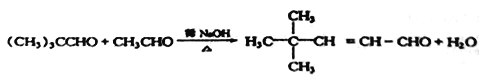 加成(或还原)反应 4,4-二甲基-1-戊醇
加成(或还原)反应 4,4-二甲基-1-戊醇 ![]() 8(7)
8(7) ![]()
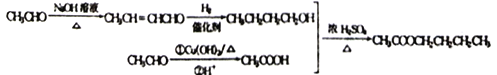
【解析】根据流程和J是酯类化合物可知F为酸,I含有-OH,G与I的碳链结构相同,根据j的结构特点逆推可得G的结构简式为![]() ,从而H的结构简式为
,从而H的结构简式为![]() ,I中含有的碳原子数为8,所以F分子中含有7个碳原子,C、D、E、F中的碳原子数均为7,E为醛类化合物,则B也为醛类,B的相对分子质量为44,所以B为CH3CHO,A也为醛类,且含碳原子数为5个,所以A的分子式为C5H10O,A中只有两种峰,故A的结构简式为(CH3)3CCHO,根据信息可写出C的结构简式为
,I中含有的碳原子数为8,所以F分子中含有7个碳原子,C、D、E、F中的碳原子数均为7,E为醛类化合物,则B也为醛类,B的相对分子质量为44,所以B为CH3CHO,A也为醛类,且含碳原子数为5个,所以A的分子式为C5H10O,A中只有两种峰,故A的结构简式为(CH3)3CCHO,根据信息可写出C的结构简式为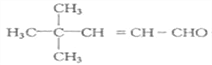 。
。
(1根据上面G的结构简式可知G中含有的官能团为醚键和酚羟基。
(2)由上已知A、B、C的结构,根据已给信息写出A和B生成C的化学方程式为: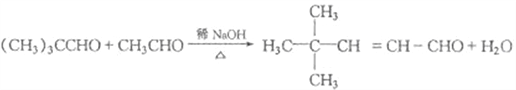 。
。
(3)C中含有碳碳双键和醛基,与H2发生加成反应;C与H2加成生成的D的结构简式为(CH3)3CCH2CH2CH2OH,主链从离羟基近的一端开始编号,名称为4,4-二甲基-1-戊醇。
(4)H分子中含有官能团-Cl,在NaOH溶液中发生水解反应,生成醇类,化学方程式为: 。
。
(5) G的结构简式为![]() ,同分异构体中,苯环上的一氯代物只有一种,则有两种情况,一是苯环上有两个相同的对位取代基,可能为两个-CH2OH或-O-CH3:
,同分异构体中,苯环上的一氯代物只有一种,则有两种情况,一是苯环上有两个相同的对位取代基,可能为两个-CH2OH或-O-CH3:![]() 、
、![]() ,共有2种同分异构体;二是苯环上有四个取代基,且是两个-OH和两个-CH3,先固定2个-OH的位置,有邻、间、对三种关系,然后再移动两个-CH3,共有6种结构:
,共有2种同分异构体;二是苯环上有四个取代基,且是两个-OH和两个-CH3,先固定2个-OH的位置,有邻、间、对三种关系,然后再移动两个-CH3,共有6种结构: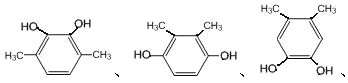
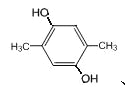
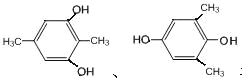 ,故符合条件的总共有8种同分异构体;核磁共振氢谱显示两组峰,则苯环上可能有2个对位取代基,且是醚键,结构简式为
,故符合条件的总共有8种同分异构体;核磁共振氢谱显示两组峰,则苯环上可能有2个对位取代基,且是醚键,结构简式为![]() 。
。
(6) 乙酸正丁酯的单体分别是乙酸和正丁醇,乙酸可由乙醛氧化得到,根据已知信息两分子乙醛在稀NaOH溶液中反应生成CH3-CH=CH-CHO,然后在催化剂作用下与H2加成生成正丁醇,最后乙酸与正丁醇在浓硫酸的作用下发生酯化反应生成乙酸正丁酯,故合成路线图为: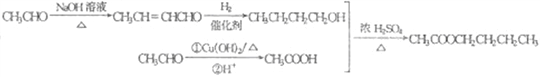 。
。


科目:高中化学 来源: 题型:
【题目】下列所发生的反应中,属于酯化反应的是( )
A. 实验室用乙醇、乙酸和浓硫酸反应 B. 将苯滴入溴水中,振荡后水层接近无色
C. 乙烯使酸性高锰酸钾溶液褪色 D. 甲烷与氯气混合,黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH等。
回答下列问题:
(1)CH3SH(甲硫醇)的电子式为__________。
(2)CO和H2S反应可产生羰基硫( COS)。在一恒容密闭容器中发生反应:CO(g)+H2S(g)![]() COS(g)+H2(g)并达到平衡,数据如下表所示:
COS(g)+H2(g)并达到平衡,数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应是________反应(填“吸热”或“放热”)。
②实验1达平衡时,CO的转化率为_______。
③实验2达到平衡时,a_______7.0(填“大于”“小于”或“等于”)。
④实验3达平衡后,再充入1.0 molH2,平衡常数值____(填“增大”“减小”或“不变”)。
(3)COS是大气污染物。在酸性溶液中可用H2O2氧化COS生成一种强酸脱硫。该脱除反应的化学方程式为_______________。
(4)有一种脱硫工艺为:真空K2CO3一克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3 +H2S =KHS +KHCO3,该反应的平衡常数的对数值为lgK=_____(已知:H2CO3 lgK1=-6.4,lgK,2=- 10.3;H2S lgKl=-7.0,lgK
②已知下列热化学方程式:
a. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H1=-1172kJ/mol
b. 2H2S(g)+O2(g)=2S(s)+2H2O(1) △H2 = 632 kJ/mol
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. 羟基的电子式: ![]() B. 中子数为16的磷原子:3115P
B. 中子数为16的磷原子:3115P
C. 氟原子的结构示意图: ![]() D. HClO的结构式:H-C1-O
D. HClO的结构式:H-C1-O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO(MgO占40%,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质),以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
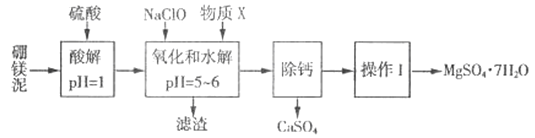
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸800 mL,若用18.4 mol/L的浓硫酸来配制,则量取浓硫酸时,需使用的量筒规格为_______。(填字母)
A.10 mL B.25 mL C.50 mL D.100 mL
(2)加入的NaClO 可与酸解液中Mn2+ 反应:Mn2+ + ClO-+H2O= MnO2 ↓+ 2H+ + Cl-,溶液中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________。该步骤中,物质X是________(填化学式)。
(3)“滤渣”中除MnO2、CaSO4 外还有_______。(填化学式)
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 | |
溶解度/g | MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 | |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤:____________。
(5)“操作I”是将滤液经过一系列操作后真空干燥,采用“真空干燥”的原因是________。
(6)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O 为147.6 g,则MgSO4·7H2O的产率为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某NaHCO3样品的纯度(杂质为NaCl),进行如下实验:
(1)称取2.000g样品,配成200mL待测液,配制待测液所需定量仪器有;
(2)在锥形瓶中放入20.00mL待测液,滴加2滴甲基橙,摇匀.用0.100mol/L的标准盐酸滴定,边滴边摇动锥形瓶,眼睛注视 . 直到滴入最后一滴盐酸,溶液颜色由色变为色,并在内不发生变化,停止滴定,记录读数.
(3)重复滴定实验1~2次,计算平均消耗盐酸22.60mL.重复实验的目的是 .
(4)所配待测液中NaHCO3的浓度为mol/L;样品中NaHCO3的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com