
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
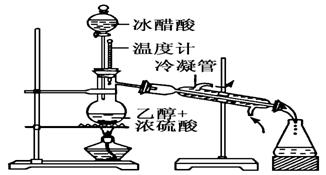
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其中浓硫酸作用的是______________________________________
(2)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1 mol乙酸乙酯?________(填能、否)
(3)写出乙酸与小苏打溶液反应的离子方程式______________________________
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
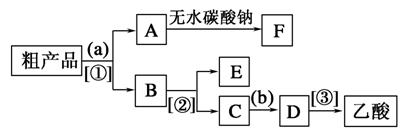
试剂a是__________ ,分离方法②是________
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生
0.78 g白色沉淀,则加入的NaOH溶液的体积可能为 ( )
A.3 mL B.7.5 mL
C.15 mL D.17.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
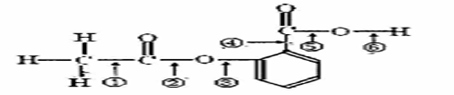
在阿斯匹林的结构简式(下图所示)中①②③④⑤⑥分别标出了其分子中的不同的键。
将阿斯匹林与足量NaOH溶液共煮时,发生反应时断键的位置是( )
A.①④
B.②⑤
C.②⑥
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A、研究有机物的一般步骤是:分离、提纯→确定化学式→确定实验式→确定结构式
B、在碱性条件下,将0.1mol的CH3CO18OC2H5水解,所得乙醇的相对分子质量为48
C、制硝基苯、银镜反应、溴乙烷的水解、酯的水解实验条件都是水浴加热
D、裂化汽油、聚1,3-丁二烯、福尔马林溶液都能使溴水褪色,但原理不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
在同温同压下,某有机物和过量Na反应得到V1 L氢气,另一份等量的该有机物和足量的NaHCO3溶液反应得到V2 L二氧化碳,若V1=V2≠0,则该有机物可能是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.含有羟基的化合物一定属于醇类
B.代表醇类的官能团是跟链烃基相连的羟基
C.醇类和酚类具有相同的官能团,因而具有相同的化学性质
D.分子内有苯环和羟基的化合物一定是酚类
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是( )
| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 证明乙醇发生消去反应生成乙烯 | 将乙醇与浓硫酸混合加热到170℃,将产生的气体通入溴水 | 酒精灯、圆底烧瓶、导管、试管 |
| B | 证明HClO和CH3CO OH的酸性强弱 | 同温下用pH试纸测定浓度为0.1mol·L-1 NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分 钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
| D | 配制1 L 1.6%的CuSO4溶液(溶液密度近似为1g/mL) | 将25g CuSO4·5H2O溶解在975g 水中 | 烧杯、量筒、玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟 工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
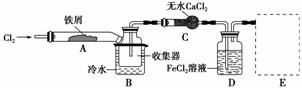
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用 干燥的N2赶尽Cl2,将收集器密封。
干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为_______________________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是__________________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为______________________________________________;
装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:_________________________________________。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为_________________________________________
________________________________________________________________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________。
(8)综合分析实验 Ⅱ 的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;
②_________________________________________________ _______________________。
_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com