
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下如图。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。

由此推知:
A________,B________,C________,D________,E________(填元素名称)
科目:高中化学 来源: 题型:
【题目】在一定条件下的定容密闭容器中,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g), 下列哪种情况,能表明反应达到平衡状态
2SO3(g), 下列哪种情况,能表明反应达到平衡状态
A. SO3的体积百分含量保持不变
B. SO2速率是O2速率的2倍
C. SO3的浓度是O2浓度的2倍
D. 单位时间内SO2消耗的浓度等于SO3生成的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)![]() 3Z(g)平衡时, X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、 Z的体积分数不变。下列叙述不正确的是( )
3Z(g)平衡时, X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、 Z的体积分数不变。下列叙述不正确的是( )
A.m=2 B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为 1∶1 D.第二次平衡时,Z的浓度为 0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
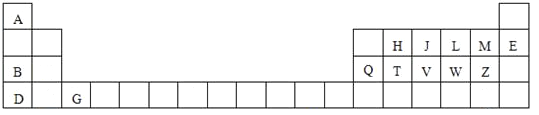
(1)原子半径最大的元素是 _____;在化合物中只有负价的元素是 ______;属于副族元素是____;适合作半导体材料的是____,(只用表中的字母填写)
(2)V在周期表中的位置第____周期第______族.
(3)A与M元素形成的化合物是______化合物,D与Z原子形成的化学键是____键;
(4)J、H、T三种元素的最高价含氧酸的酸性由强到弱的顺序是___________________________________;(用化学式表示)
(5)L元素形成的氢化物的在-4℃时是__________晶体(填晶体类型),其密度比对应的液态还小,呈固体而非气体的原因是____________________________________。
(6)写出B、Q两种元素的氧化物对应的水化物相互反应的化学方程式_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组物质中,分子数一定相同的是 ( )
A.0.2mol H2和4.48L HCl气体
B.标准状况下1mol O2和22.4L H2O
C.4g 氦气和标准状况下22.4LCO2
D.4L CO和4L CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积固定的密闭容器中,进行可逆反应A(s)+3B(g)![]() 3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
①C的生成速率与C的分解速率相等;②单位时间内生成amol A,同时生成3amol B;
③B的浓度不再变化; ④混合气体总的物质的量不再发生变化;
⑤A、B、C的物质的量之比为1:3:3; ⑥混合气体的密度不再变化;
A. ①③⑥ B. ①③④⑥ C. ①②③ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 有一瓶澄清溶液,可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl―、I―现进行如下实验:
①测知溶液显强酸性;②取样加少量CCl4和数滴新制氯水,CCl4层为紫红色;
③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程中均无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润红色石蕊试纸变蓝。
请回答:(1)原溶液中肯定存在的离子是____________________
(2)不能确定是否存在的离子是____________________
Ⅱ.(1)某兴趣小组同学汲取热电厂附近的雨水进行实验。雨水样品在空气中放置2小时后,通过测定发现雨水样品的酸性会增强,你认为会形成溶液酸性这一变化的原因是(用离子方程式表示)________________________________________________
(2)正常雨水的溶液也是偏酸性,这是因为_____________________________________
(3)该兴趣小组同学为测定空气中二氧化硫的体积分数,做了如下实验:取标准状况下的空气1.000L(内含氮气 、氧气 、二氧化硫、二氧化碳等),慢慢通过足量氯水,(反应的化学方程式为SO2+Cl2+H2O=2HCl+H2SO4),在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g。计算该空气样品中二氧化硫的体积分数_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
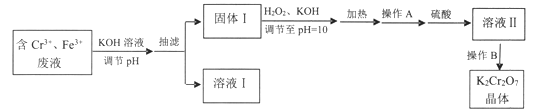
【题目】某研究性小组用含铬废水制取具有强氧化性的重铬酸钾(K2Cr2O7),实验方案如下:
已知:
①Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
②金属离子沉淀的PH如下:
离子 | 开始沉淀的PH | 沉淀完全的PH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 4.1 |
③不同温度下化合物的溶解度如下:
物质 | 溶解度/(g/110g水) | ||
0℃ | 40℃ | 80℃ | |
K2SO4 | 7.4 | 14.8 | 21.4 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
请回答:
(1)操作A的名称是____,加入硫酸的目的是_____。
(2)写出固体1中加入H2O2和KOH溶液后发生反应的离子方程式________。
(3)操作B由多步组成,获得K2Cr2O7晶体的操作依次是:蒸发浓缩、操作1、洗涤1、操作2、抽滤、洗涤2、干燥。则下列说法正确的是__________。
A.操作1和操作2分别是趁热过滤和冷却结晶
B.洗涤1和洗涤2所用的洗涤剂分别为0℃的冷水和80℃的热水
C.当溶液出现过饱和现象时,振荡容器或用玻璃棒轻轻摩擦器壁均可促使晶体析出
D.进行洗涤2操作时,可用摩尔盐[(NH4)2SO4·FeSO4·6H2O]标准溶液滴定,反应的离子方程式:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①请简述将已用移液管吸取的待测液转移至锥形瓶中的操作__________。
②滴定时,先称取0.5000g K2Cr2O7 产品,溶于水配成100mL溶液,用0.1000mol/L的摩尔盐标准溶液进行滴定,数据记录如下:
实验序号 | 待测样品溶液的体积/mL | 0.1000mol/L摩尔盐溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 24.98 |
2 | 25.00 | 1.56 | 29.30 |
3 | 25.00 | 1.00 | 26.02 |
则测得K2Cr2O7产品的纯度是_________(以质量分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com