
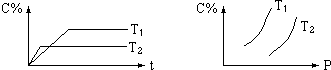
| A. | T1<T2 | B. | m+n<e | ||
| C. | 正反应是吸热反应 | D. | 逆反应是放热反应 |
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 6.72L | C. | 2.8L | D. | 13.44L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
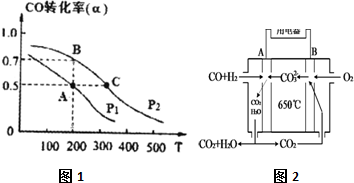
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
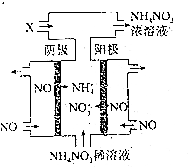
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
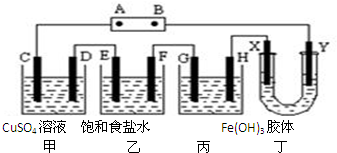 将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )
将下列装置如图连接,D、F、X、Y、E 都是铂电极,C是铁电极.甲,乙,丙三个装置中电解前后溶液的体积都是500mL.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.下列说法不正确的是( )| A. | 电源B 极的名称是负极,丁中Y极附近颜色变深 | |
| B. | 乙装置中电解一段时间后,加入0.2mol盐酸则可以恢复原来的浓度 | |
| C. | 设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L | |
| D. | 甲装置中电解反应的总化学方程式是:CuSO4+Fe$\frac{\underline{\;电解\;}}{\;}$Cu+FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ① | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com