
【题目】下列叙述中,不能用平衡移动原理解释的是
A. 用排饱和食盐水的方法收集氯气
B. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
C. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
D. 锌与稀硫酸反应,加入少量硫酸铜反应速率加快
【答案】D
【解析】
A.实验室用排饱和食盐水法收集氯气,利用饱和食盐水中氯离子浓度使平衡逆向进行,Cl2+H2O![]() H++Cl-+HClO,可以用平衡移动原理解释,A不选;
H++Cl-+HClO,可以用平衡移动原理解释,A不选;
B.SO2催化氧化制SO3的过程中使用过量的氧气,增大氧气浓度平衡正向进行,提高了二氧化硫的转化率,可以用平衡移动原理解释,B不选;
C.加入硝酸银溶液后,生成AgBr沉淀,使溴离子浓度减小,平衡Br2+H2O![]() HBr+HBrO正向移动,促进溴与水的反应,溶液颜色变浅,可用平衡移动原理解释,C不选;
HBr+HBrO正向移动,促进溴与水的反应,溶液颜色变浅,可用平衡移动原理解释,C不选;
D.锌与稀硫酸反应,加入少量硫酸铜溶液,Zn与CuSO4发生置换反应反应,产生Cu单质,Zn、Cu及稀硫酸构成了Cu-Zn原电池,原电池反应加快化学反应速率,所以不能用平衡移动原理解释,D选;
故合理选项是D。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量。如H-H键的键能是436kJ/mol,H—Cl键的键能是431kJ/mol,Cl—Cl键的键能是247 kJ /mol,H2和Cl2反应生成1molHCl放出的热量是( )
A.431kJB.179kJC.89.5kJD.以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学—有机化学基础)瘦肉精又名克伦特罗(4-氨基-α-叔丁胺甲基-3,5-二氯苯甲醇),是一种β2肾上腺素受体激动剂,临床上用于治疗哮喘。可由下图所示路线合成:

其中X表示某中间物质,请回答下列问题。
(1)判断反应④的反应类型 。
(2)书写反应③所代表的化学反应方程式:
。
(3)试推断中间物质X的结构简式: 。
(4)对氨基苯乙酮![]() 的同分异构体有多种,请写出符合以下条件的其中任意一种
的同分异构体有多种,请写出符合以下条件的其中任意一种
a.苯环与氨基相连 b.与新制的Cu(OH)2悬浊液加热,有红色物质生成
c.苯环上有2个取代基
(5)①②③代表的整个反应过程完成了苯胺对位的酰基化,也完成了对 (填官能团名称)的保护,同时也避免了一些副反应的发生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开CH4(g)、H2O(g)、CO2(g)中的C-H键、H-O键、C=O键各1mol分别需要吸收414kJ、463kJ、801kJ的能量。根据能量变化示意图,下列说法不正确的是( )

A.拆开1molO2(g)中的化学键时放出454kJ的能量
B.H-O键键能大于C-H键键能,说明H-O键更牢固
C.2CO(g)+O2(g)=2CO2(g),ΔH=-566kJ·mol1
D.2CH4(g)+3O2(g)=2CO(g)+4H2O(l),ΔH=-1214kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸D(β-苯基丙烯酸)用于制备化妆品、香皂的香精,乜可制造局部麻醉剂、杀菌剂、止血药、植物生长促进剂、防腐剂、感光树脂等。下列是肉桂酸D的合成与应用的反应路线:
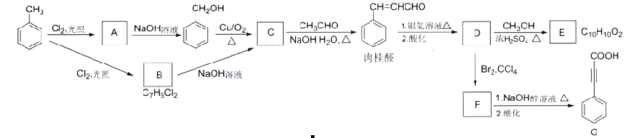
已知:![]()
(1)A的分子式是_______,A生成苯甲醇的反应类型是________。
(2)C的结构简式是_______,肉柱醛中的官能团名称是________。
(3)E是一种合成香精的定香剂,已知E为反式结构,则其结构简式为_______。
(4)在G中共直线的原子共有_______个,1molB转化为C最多消耗_______mol NaOH
(5)写出上图中F与NaOH醇溶液共热时的化学方程式________。
(6)P是E的同分异构体,写出符合下列条件的P的键线式_______。
①有两个相同的官能团;②能与新制氢氧化铜悬浊液作用产生砖红色沉淀;③含有苯环,核磁共振氢谱有三组面积之比为2︰2︰1的峰。
(7)以乙醇为原料,设计制备高分子化合物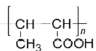 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)______
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯的叠氮酸(HN3)是一种弱酸,常温下向25mL 0.1 mol/L NaOH溶液中加入0.2 mol/L HN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如下图。下列说法正确的是( )
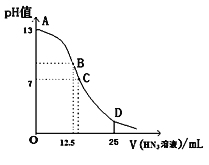
A. 该滴定过程中应用甲基橙作指示剂
B. 若B点pH=8,则c(HN3)=(10-6~10-8 )mol/L
C. 点D对应溶液中存在关系:c(HN3)>c(Na+)>c(N3-)
D. 沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰元素在多个领域中均有重要应用,回答下列问题。
(1)Mn在元素周期表中位于_____区;MnSO4中阳离子的价电子排布式为__________;
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+下列说法合理的是_______
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+产内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为_____。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__________
(4)二价锰的化合物的性质如下表所示:
物质 | MCl2 | MnS | MnSO4 |
熔点 | 650℃ | 1610℃ | 700℃ |
上表三种物质中晶格能最大的是________;上表涉及的三种阴离子中,半径最大的是______。
(5)某锰氧化物的晶胞结构如下图所示:

该锰的氧化物的化学式为______________,该晶体中Mn的配位数为____________,该晶体中Mn之间的最近距离为____________pm(用a、b来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的是
A. 2Na2O2+2H2O===4NaOH+O2↑ B. NH3+CO2+H2O===NH4HCO3
C. 2NaOH+Cl2===NaCl+NaClO+H2O D. NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1000 mol·L-1盐酸滴入20.00 mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示,下列说法正确的是
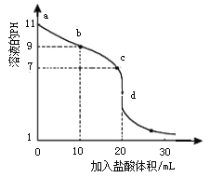
A. b点处的溶液中c(Cl-)>c(M+)>c(OH-)>c(H+)
B. 室温下,MOH的电离平衡常数Kb为1×10-5
C. c点处的溶液中c(M+)=c(Cl-)=c(H+)=c(OH-)
D. d点处的溶液中c(MOH) + c(H+) = c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com