
| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 苛性钠溶液 | D. | 四氯化碳溶液 |
科目:高中化学 来源: 题型:选择题
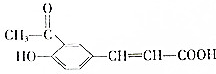
| A. | 1mol该有机物最多可与6mol H2发生加成反应 | |
| B. | 该有机物可发生水解反应、取代反应和氧化反应 | |
| C. | 加入碳酸氢钠溶液,产生气泡,说明含有羧基 | |
| D. | 加入溴水,溴水褪色,说明含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | W单质的化学性质很活泼 | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z气态氢化物稳定性最弱的是Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
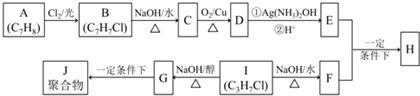
 .
. .②I→G 的化学方程式
.②I→G 的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制餐具不宜用蒸煮酸性或碱性的食物 | |
| B. | 碳酸钠可用于中和发酵面团中的酸性物质 | |
| C. | 过氧化钠可用于呼吸面具中氧气的来源 | |
| D. | 聚氯乙烯塑料制品可用于食品的包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
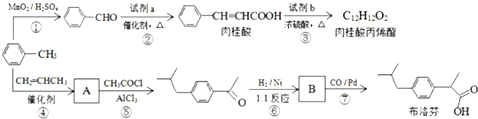
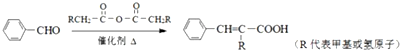
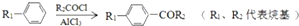
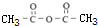 ;
;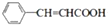 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$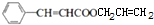 +H2O;
+H2O; ;
;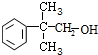 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2≈1.6×10-3 | B. | 2c(Na+)=c(HCN)+c(CN-) | ||
| C. | 混合溶液的pH<7 | D. | 对混合溶液升温,K1增大、K2减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com