

 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。| A.增大压强 | B.降低温度 | C.使用催化剂 | D.增大反应物的浓度 |
科目:高中化学 来源:不详 题型:实验题
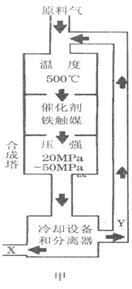
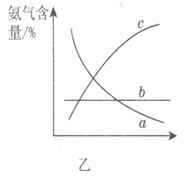
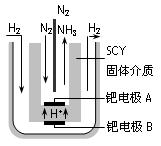
 ②图甲中条件选定的主要原因是(选填字母序号,下同)________。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。 某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
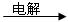 A + B + C
A + B + C
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
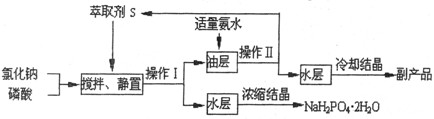
 NaH2PO4+HCl
NaH2PO4+HCl  HCl·S △H<0
HCl·S △H<0 H3PO4·S △H<0
H3PO4·S △H<0
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
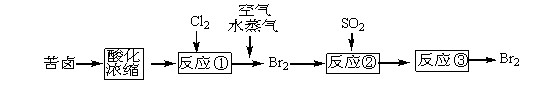
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题: H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K
H2(g) + CO(g) △H =" +131.3" kJ ,△S =" +133.7" J/K 2NH3(g) 的K=0.5。
2NH3(g) 的K=0.5。 N2 (g)+ 3H2(g)的K= (填数值)。
N2 (g)+ 3H2(g)的K= (填数值)。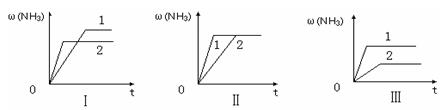
| A.图Ⅰ可能是不同压强对反应的影响,且P2>P1 |
| B.图Ⅱ可能是不同压强对反应的影响,且P1>P2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下,催化剂性能:1>2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com