
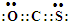 .
.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,COS和二氧化碳为等电子体,等电子体微粒的结构相似;
(2)焦亚硫酸钠放置在空气中很容易被氧化,Na2S2O5中硫元素化合价+4价,硫元素化合价升高为+6价,氧气中氧元素化合价降低,结合原子守恒书写化学方程式,焦亚硫酸钠遇水后立即生成一种酸式盐为亚硫酸氢钠;
(3)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,配平书写方程式,若仅在SO2的水溶液中滴加几滴碘水,会发生氧化还原反应,亚硫酸根离子被氧化为硫酸根离子,$\frac{[S{{O}_{3}}^{2-}]}{[HS{{O}_{3}}^{-}]}$=$\frac{[S{{O}_{3}}^{2-}][{H}^{+}]}{[HS{{O}_{3}}^{-}][{H}^{+}]}$=$\frac{Ka}{[{H}^{+}]}$;
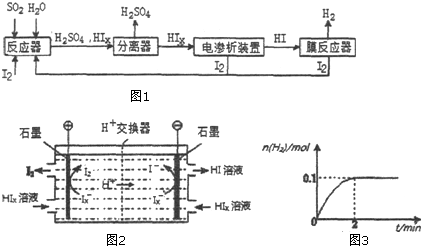
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,阳极区的H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI;
③由图可知,2min内H2物质的量的变化量,根据反应方程式写平衡表达式,结合平衡浓度计算平衡常数,若将HI通入量变为原来的4倍,反应前后气体体积不变,平衡不变,氢气所占体积分数即为氢气物质的量的分数.
解答 解:(1)①SO2(g)+2CO(g)═2C02(g)+$\frac{1}{x}$Sx(s)△H=a kJ•mol-1;
②2COS(g)+SO2(g)═2CO2(g)+$\frac{3}{x}$Sx(s)△H=b kJ•mol-1.
依据盖斯定律(②-①×2)÷2得到:xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol,
COS和二氧化碳为等电子体,等电子体微粒的结构相似,所以该气体的电子式为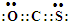 ,
,
故答案为:xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol;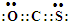 ;
;
(2)焦亚硫酸钠放置在空气中很容易被氧化,Na2S2O5中硫元素化合价+4价,硫元素化合价升高为+6价,氧气中氧元素化合价降低,结合原子守恒书写化学方程式为,Na2S2O5+O2=Na2SO4+SO3,焦亚硫酸钠遇水后立即生成一种酸式盐为亚硫酸氢钠,反应的化学方程式为:Na2S2O5+H2O=2NaHSO3 ,
故答案为:Na2S2O5+O2=Na2SO4+SO3;Na2S2O5+H2O=2NaHSO3 ;
(3)①由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2+x I2+2H2O═H2SO4+2HIX,若仅在SO2的水溶液中滴加几滴碘水,会发生氧化还原反应,亚硫酸根离子被氧化为硫酸根离子,$\frac{[S{{O}_{3}}^{2-}]}{[HS{{O}_{3}}^{-}]}$=$\frac{[S{{O}_{3}}^{2-}][{H}^{+}]}{[HS{{O}_{3}}^{-}][{H}^{+}]}$=$\frac{Ka}{[{H}^{+}]}$,反应过程中氢离子浓度增大,电离平衡常数不变,则比值减小,
故答案为:SO2+x I2+2H2O═H2SO4+2HIX,减小;
②由图2可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,所以阳极区发生的反应为:2Ix--2e-=xI2,H+通过交换膜进入阴极区,得以生成HI溶液,即电解HIx生成I2、HI,反应方程式为:2HIx═(x-1)I2+2HI,
故答案为:2Ix--2e-=xI2;2HIx=(x-1)I2+2HI;
③若向膜反应器中加入1molHI,反应为2HI?H2+I2,结合平衡三行计算列式计算,图象可知2min达到平衡状态,氢气物质的量为0.1mol,
2HI?H2+I2,
起始量(mol/L) 1 0 0
变化量(mol/L) 0.2 0.1 0.1
平衡量(mol/L) 0.8 0.1 0.1
反应前后气体体积不变,平衡常数可以利用物质的量代替平衡浓度计算,K=$\frac{0.1×0.1}{0.{8}^{2}}$=$\frac{1}{64}$,
若将HI通入量变为原来的4倍,反应前后气体体积不变,平衡不变,氢气所占体积分数即为氢气物质的量的分数=$\frac{0.1mol}{1mol}$×100%=10%,
故答案为:$\frac{1}{64}$;10%.
点评 本题考查盖斯定律计算、离子浓度大小比较、电解原理等,侧重于学生的分析能力的考查,为高考常见题型,题目难度中等,注意利用守恒思想比较溶液中微粒浓度大小.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④⑤ | C. | ①②③④⑥ | D. | ①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当溶液中c(CH3COO-)=c(Na+)>c(H+)=c(OH-)时,一定是醋酸过量 | |
| B. | 当溶液中c(CH3COO-)=c(Na+)时,一定是氢氧化钠过量 | |
| C. | 当溶液中c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全反应 | |
| D. | 当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶:500mL、250mL各一个;CuSO4:共120g | |
| B. | 容量瓶:750mL;CuSO4:120g | |
| C. | 容量瓶:1000mL;CuSO4•5H2O:160g | |
| D. | 容量瓶:1000mL;CuSO4:160g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 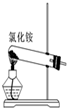 实验室用如图装置制取氨气 | |
| B. |  装置可用于制备氢氧化亚铁并观察其颜色 | |
| C. | 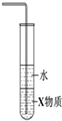 如图装置中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| D. | 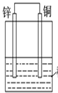 如图装置是原电池,锌电极为负极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)实验室常用装置E制备Cl2,写出该反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(1)实验室常用装置E制备Cl2,写出该反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成纤维和光导纤维都属于新型无机非金属材料 | |
| B. | “地沟油”禁止食用,但经过加T处理后,可以用来制取肥皂和生物柴油 | |
| C. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| D. | 2015年10月我国科学家屠呦呦获诺贝尔医学、生理学奖,她发现、创制的药物青篙素( )是治疗疟疾的特效药,青篙素的分子式为C15H22O5 )是治疗疟疾的特效药,青篙素的分子式为C15H22O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
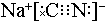 ,碳元素的化合价为+2;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2.若处理4×10-5mol•L-1的废水1000L,至少需要ClO2的质量为2.7g.
,碳元素的化合价为+2;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2.若处理4×10-5mol•L-1的废水1000L,至少需要ClO2的质量为2.7g.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com