
 能源、材料和信息是现代社会的三大“支柱”.
能源、材料和信息是现代社会的三大“支柱”.分析 (1)①Ni是28号元素,根据能量最低原则、泡利不相容原理和洪特规则,写出其核外电子排布式为:1s22s22p43s23p43d84s2,据此判断其所在位置,原子序数比其大1的原子为铜,据此书写外围电子排布式,其3d、4s电子为其外围电子;
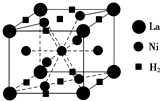
②根据镍基合金储氢后的晶胞结构图,利用均摊法,可知每个晶胞中含有La、H2的个数关系,从而可解决问题;
(2)根据元素周期律可知四种元素的电负性大小,②、根据C6H5NO3•1.5H2O中微粒间的作用力可解决问题;
(3)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO43-,根据价层电子对互斥理论确定其杂化方式.
解答 解:(1)①Ni是28号元素,其核外电子排布式为:1s22s22p43s23p43d84s2,最大主量子数为4,位于元素周期表第10列,其在元素周期表位置为:第四周期第Ⅷ族;原子序数比其大1的原子核电荷数为29,为Cu元素,核外电子排布式为1s22s22p63s23p63d104s1,其外围电子排布式是3d104s1,
故答案为:第四周期第Ⅷ族;3d104s1;
②根据镍基合金储氢后的晶胞结构图,利用均摊法,可知每个晶胞中La原子位于顶点,数目为8×$\frac{1}{8}$=1,H2分子位于面心和棱心,数目为2×$\frac{1}{2}$+8×$\frac{1}{4}$=3,所以当含1molLa时合金可吸附H2的数目为3mol,
故答案为:3mol;
(2)对硝基苯酚水合物中含O、N、C、H四种元素,H在第一周期ⅠA族,电负性在这四种元素中最小,而O、N、C都位于第二周期,且原子序数逐渐减小,根据元素周期律同周期元素随着原子序数的递增,电负性逐渐增大,可知这四种元素的电负性大小顺序为:O>N>C>H,
故答案为:O>N>C>H;
(3)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO4 3-,其电子式为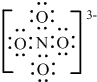 ,该离子中价层电子对=4+$\frac{1}{2}$(5+3-4×2)=4,所以N原子采用sp3杂化,
,该离子中价层电子对=4+$\frac{1}{2}$(5+3-4×2)=4,所以N原子采用sp3杂化,
故答案为:NO43-;sp3.
点评 本题考查电子排布式的书写、杂化方式的判断、电负性的判断、晶体结构等知识点,同时考查分析、解决问题的能力,应熟练掌握核外电子排布式和元素周期表中位置的关系,题目难度中等.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:Y>Z | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Y分别与Z、W形成的化合物中化学键类型不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某种核素的相对原子质量的近似值 | B. | 某种核素的相对原子质量 | ||
| C. | 某种元素的相对原子质量的近似值 | D. | 某种元素的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①MR ②MR2 ③MR3 ④MR4 | B. | ①MR ②MR2 ③MR2 ④MR | ||
| C. | ①MR2 ②MR2 ③MR2 ④MR | D. | ①MR ②MR ③MR2 ④MR2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸 | |
| B. | 分离苯和硝基苯的混合物,可用蒸馏法 | |
| C. | 除去苯中的杂质苯酚可加入浓溴水后过滤 | |
| D. | 从粗苯甲酸中提纯苯甲酸,可用重结晶法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y两种单质在常温下反应生成的产物为碱性氧化物 | |
| B. | Z2R3可由Y2R和ZCl3的溶液反应制取 | |
| C. | Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
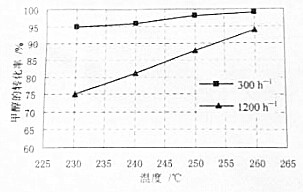 以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +4 | C. | 0 | D. | +6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com