
| A. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 小苏打用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 计算机芯片所用的材料是高纯度的硅 | |
| D. | 纯净的二氧化硅是生产光纤制品的基本原料 |
分析 A.防氧化就是防止氧气的进入并与之反应,防受潮就是防止水分的进入;
B.小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,患胃溃疡的病人,为防止胃壁穿孔,不能服用小苏打来治疗;
C.物质的结构决定物质的性质,物质的性质决定物质的用途,半导体硅晶片可以制造制造计算机芯片;
D.二氧化硅的用途之一是生产光纤制品.
解答 解:A.在食品袋中放入盛有硅胶和铁粉的透气小袋,硅胶(具有吸湿性)能吸收水分,铁是较活泼的金属,具有还原性,能防止食品被氧化,故A正确;
B.小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,患胃溃疡的病人,为防止胃壁穿孔,不能服用小苏打来治疗,因为反应产生的二氧化碳气体会造成胃部气胀,易造成胃穿孔,故B错误;
C.高纯的单晶硅是重要的半导体材料,可做成太阳能电池,各种集成电路,用于制造计算机芯片,二氧化硅是制造玻璃、水玻璃、光导纤维、电子工业的重要部件,故C正确;
D.二氧化硅是生产光纤制品的基本原料,故D正确;
故选B.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液中:Na+、Fe2+、SO42-、NO3- | |
| B. | 某无色溶液中:Mg2+、ClO-、SO42-、Fe2+ | |
| C. | 能使KSCN变红的溶液中:NH4+、Na+、SiO32-、HCO3- | |
| D. | 水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
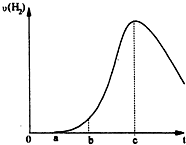 按要求完成下列问题:
按要求完成下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| B. | 常温常压下,11.2L二氧化硫中含有的氧原子数为NA | |
| C. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 标准状况下,22.4 L氦气与22.4 L氮气所含原子数均为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
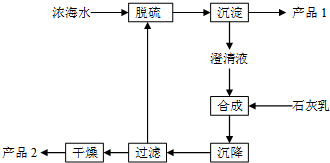 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品. _.
_.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
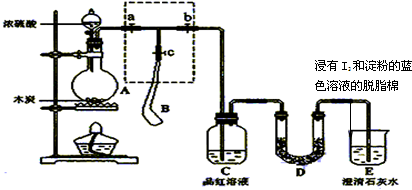
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com