
碳及其化合物有广泛的用途。
(1) 将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g) 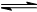 CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2) 已知:C(s)+CO2(g) 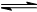 2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g) 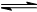 CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
(3) CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g) ===CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为_________________________________________________________________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4) 将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g) 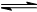 CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)________________________。
(5) 工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实条件下反应,N2浓度随时间变化如图甲所示。
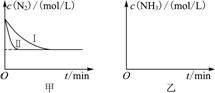
请回答下列问题:①与实验Ⅰ比较,实验Ⅱ改变的条件为____________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
已知有机物A是链状化合物,分子内只含有两种官能团,A和一些化学试剂的反应情况如下图所示:
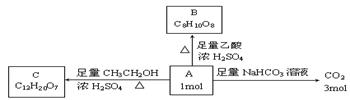
请回答下列问题:
(1)A分子内含有的两种官能团是(写名称) 。
(2)核磁共振氢谱表明A分子中有4个氢处于完全相同的化学环境。则A的结构简式是 。
(3)由A生成B的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用。下列做法与可持续发展宗旨相违背的是
A.加大清洁能源的开发利用,提高资源的利用率
B.推广碳捕集和储存技术,逐步实现二氧化碳零排放
C.加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
D.对工业废水、生活污水净化处理,减少污染物的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
用水吸收该气体可得ClO2溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率 ,具体情况如图所示。
,具体情况如图所示。
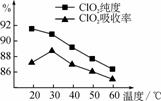
(1) 据图可知,反应时需要控制的适宜温度是________℃,要达到此要求需要采取的措施是______________。
(2) 已知:黄铁矿中的硫元素在酸性条件下可被ClO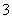 氧化成SO
氧化成SO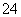 ,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
(3) 该小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:
4H++ClO2+5Fe2+===Cl-+5Fe3++2H2O
14H++Cr2O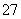 +6Fe2+===2Cr3++6Fe3++7H2O
+6Fe2+===2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各反应对应的离子方程式正确的是( )
A.次氯酸钠溶液中通入过量二氧化硫ClO- + H2O + SO2 = HClO + HSO3-
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3-+ Ca2++2OH-= CaCO3↓+2H2O+CO32-
C.氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH-+ H++SO42— = BaSO4↓+H2O
D.50 mL 1mol/L的NaOH溶液中通入0.03 mol H2S 5OH- + 3H2S = HS— + 2S2- + 5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96 L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
C.含1 mol FeCl3的溶液中Fe3+的个数为NA
D.1.8g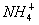 中含有的电子数为0.1NA
中含有的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
1 L某混合溶液中可能含有的离子如下表:
| 可能大量含有的阳离子 | H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 | Cl- Br- I‑ ClO‑ AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生 沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
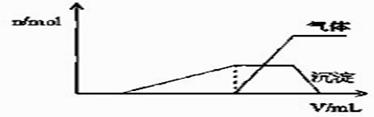
①则该溶液中确定含有的离子有 ; ②不能确定是否含有的阳离子有 , ③要确定其存在可补充做的实验是 ; ④肯定不存在的阴离子有 。
(2)经检测,该溶液中含有大量的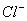 、
、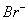 、
、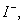 若向1 L该混合溶液中通入一定量的
若向1 L该混合溶液中通入一定量的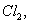 溶液中
溶液中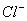 、
、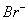 、
、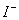 的物质的量与通入
的物质的量与通入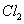 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积 (标准状况) | 2.8 L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
①当通入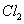 的体积为2.8 L时,溶液中发生反应的离子方程式为 。 ②原溶液中
的体积为2.8 L时,溶液中发生反应的离子方程式为 。 ②原溶液中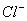 、
、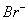 、
、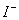 的物质的量浓度之比为 。
的物质的量浓度之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
家用管道煤气的主要成分是CO、H2、CH4,取1 L管道煤气充分燃烧需要同温同压下的空气5 L(氧气的体积分数为20%),则CO、H2、CH4的体积比不可能
A.1∶1∶1 B.1∶1∶2 C.2∶4∶3 D.1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:
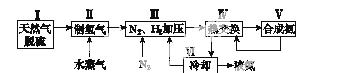
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:______________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
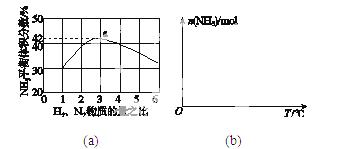
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:_______________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com