
分析 金属晶体有四种堆积方式,分别是简单立方堆积、体心立方堆积、六方最密堆积、面心立方堆积,这四种堆积中配位数分别是6、8、12、12,据此分析解答.
解答 解:金属晶体有四种堆积方式,分别是简单立方堆积、体心立方堆积、六方最密堆积、面心立方堆积,
(1)Po属于简单立方堆积,晶胞图为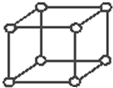 ,其配位数是6,故答案为:Po;6;
,其配位数是6,故答案为:Po;6;
(2)钾型的是K、Fe和Na,晶胞图为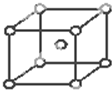 ,配位数8,
,配位数8,
故答案为:K、Fe和Na;8;
(3)镁型的是Mg、Zn和Ti,晶胞图为 ,配位数为12,
,配位数为12,
故答案为:Mg、Zn;12;
(4)铜型的是Cu、Ag和Au,晶胞图为 ,配位数为12,
,配位数为12,
故答案为:Cu、Au;12.
点评 本题考查金属晶体堆积模型,为高频考点,侧重考查学生分析及空间想象能力,难点是配位数的判断及空间利用率计算,注意晶胞中哪些原子紧挨着,为易错点.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | X的单质一定能将Y从NaY的水溶液中置换出来 | |
| C. | X的单质比Y的单质更容易与氢气反应 | |
| D. | X的氢化物水溶液的酸性一定比Y的氢化物水溶液的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各元素的最高正化合价跟族的序数相等 | |
| B. | 所有元素都有正化合价和负化合价,它们的绝对值之和等于8 | |
| C. | 非金属元素的负化合价,等于原子最外层达到8个电子稳定结构所需得到的电子数 | |
| D. | 各元素原子的最外层电子数跟族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:MgO>CaS | B. | 熔点:Li>Na | ||
| C. | 沸点:SiCl4>CF4 | D. | 沸点:邻硝基苯酚>间硝基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有氢氧化钠 | B. | 碳酸钠和氢氧化钠 | ||
| C. | 碳酸氢钠和氢氧化钠 | D. | 只有碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
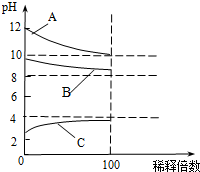 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com