
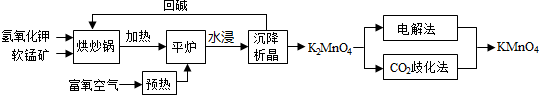
分析 (1)固体混合粉碎目的是增大接触面积加快反应速率;
(2)流程分析可知平炉中发生的反应是氢氧化钾、二氧化锰和氧气加热反应生成锰酸钾和水;
(3)“平炉”中加压能提高氧气的压强,加快反应速率,增加软锰矿转化率;
(4)①在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,根据元素守恒以及二氧化碳过量推测反应生成KMnO4,MnO2和KHCO3;
②“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-;在阴极,水电离产生的H+获得电子变为氢气逸出,电极反应式是:2H2O+2e-=H2↑+2OH-;
③依据电解法方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2H2↑+2KOH,可知K2MnO4的理论利用率是100%,而在二氧化碳歧化法反应中3K2MnO4+2CO2=2KMnO4+MnO2+K2CO3中K2MnO4的理论利用率是$\frac{2}{3}$;
(5)依据离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可由n(H2C2O4)计算出n(KMnO4),进而计算出样品中的n(KMnO4),然后可计算样品的纯度.
解答 解:(1)原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是增大接触面积加快反应速率,提高原料利用率.
故答案为:增大反应物接触面积,加快反应速率,提高原料利用率;
(2)流程分析可知平炉中发生的反应是氢氧化钾、二氧化锰和氧气加热反应生成锰酸钾和水,反应的化学方程式为:2MnO2+4KOH+O2=2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2=2K2MnO4+2H2O;
(3)“平炉”中加压能提高氧气的压强,加快反应速率,增加软锰矿转化率.
故答案为:提高氧气的压强,加快反应速率,增加软锰矿转化率;
(4)①在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,根据元素守恒以及二氧化碳过量推测反应生成KMnO4,MnO2和KHCO3;
故答案为:KHCO3;
②“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-.电极反应式是:MnO42--e-=MnO4-;在阴极,水电离产生的H+获得电子变为氢气逸出,电极反应式是:2H2O+2e-=H2↑+2OH-;所以阴极逸出的气体是H2;总反应方程式是:2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2H2↑+2KOH,
故答案为:MnO42--e-=MnO4-;H2;
③依据电解法方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+2H2↑+2KOH,可知K2MnO4的理论利用率是100%,而在二氧化碳歧化法反应中3K2MnO4+2CO2=2KMnO4+MnO2+K2CO3中K2MnO4的理论利用率是$\frac{2}{3}$,所以二者的理论利用率之比为3:2,
故答案为:3:2;
(5)依据离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
可知KMnO4与草酸反应的定量关系是2KMnO4~5H2C2O4,
n(H2C2O4)=20.00×10-3L×0.2000mol/L=20.00×10-3×0.2000mol
n(KMnO4)=20.00×10-3×0.2000×$\frac{2}{5}$mol,
1.0800g样品中n(KMnO4)=20.00×10-3×0.2000×$\frac{2}{5}$×$\frac{100}{24.48}$mol,
1.0800g样品中m(KMnO4)=20.00×10-3×0.2000×$\frac{2}{5}$×$\frac{100}{24.48}$×158g,
样品的纯度=$\frac{20.00×1{0}^{-3}×0.2000×\frac{2}{5}×\frac{100}{24.48}×158}{1.0800}$×100%.
故答案为:$\frac{20.00×1{0}^{-3}×0.2000×\frac{2}{5}×\frac{100}{24.48}×158}{1.0800}$×100%.
点评 本题考查了物质制备工艺流程的知识.制备方案的过程分析和物质性质的理解应用,特别是电解原理、滴定实验的熟练掌握和计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | X的分子式为C12H16O3 | |
| B. | 可用酸性高锰酸钾溶液区分苯和X | |
| C. | 若单键可以旋转,有机物X中一定在同一平面上的碳原子数为8 | |
| D. | 在Ni作催化剂的条件下,1 molX最多只能与1molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-能大量共存 | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13 mol•L-1的溶液中:NH4+、SO42-、NO3-能大量共存 | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-═2C6H5OH+CO32- | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
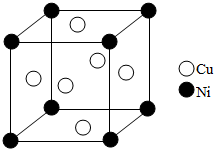 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L CO2气体中含有的氧原子数为0.5NA | |
| C. | 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA | |
| D. | 0.1L0.5mol/L CH3COOH溶液中含有的H+数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羽毛球拍属于复合材料 | B. | 包装纸箱属于无机材料 | ||
| C. | 塑料笔杆属于高分子材料 | D. | 生肖纪念币属于合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 | |
| B. | 比较Mg,Al,Zn三种金属-空气电池,Al-空气电池的理论比能量最高 | |
| C. | M-空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne-=4M(OH)n | |
| D. | 在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com